
 )④
)④ ⑤葡萄糖⑥蛋白质.
⑤葡萄糖⑥蛋白质.| A. | ①③⑤ | B. | ②④⑥ | C. | ②③④ | D. | ①⑤⑥ |
分析 既能与NaOH溶液反应,又能与硝酸反应的有两性氧化物、两性氢氧化物、铝单质、弱酸的酸式盐、弱酸弱碱盐,能发生水解反应的是弱酸盐或弱碱盐,据此分析.
解答 解:①Al2O3为两性氧化物,但不能发生水解,故错误;
②(NH4)2CO3可与氢氧化钠反应生成碳酸钠、氨气,与硝酸反应生成二氧化碳,为弱酸弱碱盐,可发生互促水解,故正确;
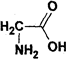
③甘氨酸( )含有氨基,可与酸反应,含有羧基,可与氢氧化钠反应,但不能发生水解,故错误;
)含有氨基,可与酸反应,含有羧基,可与氢氧化钠反应,但不能发生水解,故错误;
④ 含有酚羟基,可与氢氧化钠反应,为弱酸盐,可发生水解反应,可发生酸反应,故正确;
含有酚羟基,可与氢氧化钠反应,为弱酸盐,可发生水解反应,可发生酸反应,故正确;
⑤葡萄糖不能发生水解,与酸、碱都不反应,故错误;
⑥蛋白质含有氨基、羧基,具有两性,可水解生成氨基酸,故正确.
故选B.
点评 本题考查了常见物质的化学性质的应用,为高频考点,主要是掌握各类物质发生反应的基本原理和生成产物,能快速判断与酸碱和水的反应,题目难度不大.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑥ | B. | ④⑥⑦ | C. | ③④⑦ | D. | 以上都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 的分子式为C10H16O;其含有的含氧官能团名称是醛基.
的分子式为C10H16O;其含有的含氧官能团名称是醛基. .
. .生成B物质的反应类型为:取代反应.
.生成B物质的反应类型为:取代反应.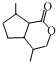 的同分异构体
的同分异构体 .(任写一种)
.(任写一种) 的合成路线图(无机试剂任选),合成路线流程图如下:
的合成路线图(无机试剂任选),合成路线流程图如下:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
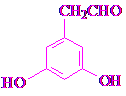 (任写一种).
(任写一种).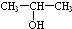 和HCHO为原料制备
和HCHO为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C$\stackrel{←}{=}$O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: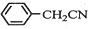 +HO2+H2SO4$\stackrel{100-130℃}{→}$
+HO2+H2SO4$\stackrel{100-130℃}{→}$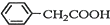 +NH4HSO4
+NH4HSO4 +Cu(OH)2→(
+Cu(OH)2→( )2Cu+H2O
)2Cu+H2O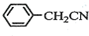 )到硫酸溶液中,然后升温至130℃继续反应,仪器c的名称是球形冷凝管.反应结束后加适量冷水,再分离出苯乙酸(
)到硫酸溶液中,然后升温至130℃继续反应,仪器c的名称是球形冷凝管.反应结束后加适量冷水,再分离出苯乙酸(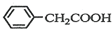 )粗品.加入冷水的目的是便于苯乙酸析出.
)粗品.加入冷水的目的是便于苯乙酸析出.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com