
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
分析 由表格数据可知,反应2SO2(g)+O2(g)?2SO3(g)从正反应开始,3~4min和7~9min的物质的量均不发生变化,且3~4min与7~9min比较,生成物的物质的量增大,则改变条件平衡正向移动,以此来解答.
解答 解:①由表格数据可知,3~4min和7~9min时,物质的量不变,反应处于平衡状态,故答案为:3~4min和7~9min;
②3~4min与7~9min比较,生成物的物质的量增大,则改变条件平衡正向移动,该反应为放热反应,且体积减小的反应,可知第5min时,从速率和转化率两个方面可知,速率加快,转化率增大,则改变的外界条件是增大压强,故答案为:增大压强.
点评 本题考查化学平衡的建立,为高频考点,把握数据分析与应用、化学状态的特征为解答的关键,侧重分析与应用能力的考查,注意5min时反应物减少比前一段时间多,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 稳定性:H2O>NH3 | B. | 碱性:NaOH>Al(OH)3 | ||
| C. | 氧化性:F2>Cl2 | D. | 酸性:H2SO4>HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| B. | 地沟油的主要成分和汽油、柴油相同,可以添加到汽油中做燃料 | |
| C. | K2FeO4和明矾都可做水处理剂,但工作原理不完全相同 | |
| D. | “水滴石穿”、“绳锯木断”的过程中都包含化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
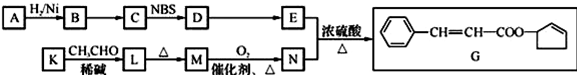
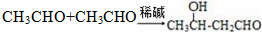
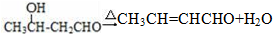
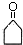 .
. .
.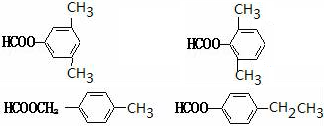 任意2种.
任意2种.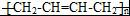 ).请设计合成路线(其他无机原料任选)并用如下方式表示:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物HOCH2CH2CH2CH3$→_{△}^{浓硫酸}$CH2=CHCH2CH3$\stackrel{NBS}{→}$CH2=CHCHBrCH3$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2$\stackrel{催化剂}{→}$
).请设计合成路线(其他无机原料任选)并用如下方式表示:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物HOCH2CH2CH2CH3$→_{△}^{浓硫酸}$CH2=CHCH2CH3$\stackrel{NBS}{→}$CH2=CHCHBrCH3$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2$\stackrel{催化剂}{→}$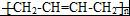 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO-)=c(Na+)时,参加反应的乙酸与氢氧化钠的物质的量之比为1:1 | |
| B. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-)时,不一定是醋酸过量 | |
| C. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,一定是氢氧化钠过量 | |
| D. | c(CH3COO-)=c(Na+)时,该溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
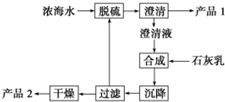 海水淡化及海水资源的提取利用是当今化工行业重要课题.
海水淡化及海水资源的提取利用是当今化工行业重要课题.| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A与C可形成共价化合物 | |
| B. | A的简单氢化物的稳定性大于C的简单氢化物的稳定性 | |
| C. | 原子半径:A<B<C | |
| D. | B的氧化物的熔点比A的最高价氧化物熔点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、X、Y、Z原子的核外最外层电子数的总和为22 | |
| B. | 上述四种元素的原子半径大小为W<X<Y<Z | |
| C. | 有W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 | |
| D. | W与Y可形成既含极性共价键又含非极性共价键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2和KOH | B. | NaHCO3和Ca(OH)2 | C. | AlCl3和氨水 | D. | HCl和Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com