
 在稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、三氧化钨、铁片和木炭粉9种物质中,存在下面的相互关系,选择①~⑤为适当的物质,使有连线的两种物质能发生反应.
在稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、三氧化钨、铁片和木炭粉9种物质中,存在下面的相互关系,选择①~⑤为适当的物质,使有连线的两种物质能发生反应.分析 在题目提供的物质中,单质①与酸②反应,则①为Fe、②为H2SO4,酸能与盐⑤反应,则⑤为Na2CO3,氧化物④能与⑤反应,则④为CaO,二者氧化物③能与氧化物④反应,则③为CO2,据此解答.
解答 解:(1)在题目提供的物质中,单质①与酸②反应,则①为Fe、②为H2SO4,酸能与盐⑤反应,则⑤为Na2CO3,氧化物④能与⑤反应,则④为CaO,二者氧化物③能与氧化物④反应,则③为CO2,
故答案为:Fe;H2SO4;CO2;CaO;Na2CO3;
(2)①和②反应的化学方程式:Fe+H2SO4=FeSO4+H2↑;
②和④反应的化学方程式:H2SO4+CaO=CaSO4+H2O;
②和⑤反应的化学方程式:H2SO4+2NaHCO3=Na2SO4+2CO2↑+2H2O;
③和④反应的化学方程式:CaO+CO2=CaCO3,
故答案为:Fe+H2SO4=FeSO4+H2↑;H2SO4+CaO=CaSO4+H2O;H2SO4+Na2CO3=Na2SO4+CO2↑+H2O;CaO+CO2=CaCO3.
点评 本题考查无机物的推断,侧重于基础知识的考查,难度不大,根据提供物质的性质以及转化关系进行判断.


科目:高中化学 来源: 题型:解答题
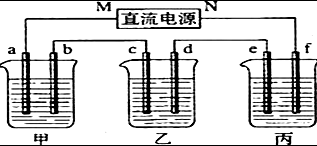 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| A. | 该反应的正方应为吸热反应 | |
| B. | 达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小 | |
| C. | 容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长 | |
| D. | 若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH3 0.15 mol 和H2O 0.10 mol,则反应将向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最终得到7.8g的沉淀 | |
| B. | 反应过程中得到6.72L(标准状况)的气体 | |
| C. | 最终得到的溶液中c(NaCl)=2.0mo/L | |
| D. | 最终得到的溶液中Al元素都以Al(OH)3形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在:c (Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol/L:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) | |
| D. | 常温下,将0.1 mol/L CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液的Kac(H+)值减小到原来的$\frac{1}{10}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新平衡时SO2的浓度是0.1mol•L-1 | |
| B. | 新平衡时NO2的转化率为20% | |
| C. | 新、旧平衡时容器内混合气体的平均相对分子质量之比为5:3 | |
| D. | 新、旧平衡时容器内气体的压强之比是5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16种 | B. | 8种 | C. | 4种 | D. | 2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com