
分析 (1)氧化铁与稀硫酸反应生成硫酸铁与水;
(2)氯化铁与氢氧化钠反应生成氢氧化铁沉淀和氯化钠;
(3)盐酸与碳酸氢钠反应生成氯化钠、水和二氧化碳;
(4)二氧化碳少量反应生成碳酸钙和水;
(5)Cu2++2OH-=Cu(OH)2↓表示可溶性铜盐与强碱反应生成氢氧化铜沉淀和可溶性盐.
解答 解:(1)用稀硫酸清除铁锈(Fe2O3),离子方程式:Fe2O3+6H+=2Fe3++3H2O;
故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)FeCl3溶液中加入NaOH溶液,反应的离子方程式:Fe3++3OH-═Fe(OH)3↓;
故答案为:Fe3++3OH-═Fe(OH)3↓;
(3)盐酸与碳酸氢钠反应生成氯化钠、水和二氧化碳,离子方程式:H++HCO3-=CO2↑+H2O;
故答案为:H++HCO3-=CO2↑+H2O;
(4)少量CO2通入澄清石灰水中,反应生成碳酸钙和水,离子方程式:CO2+Ca2++2OH-═CaCO3↓+H2O;
故答案为:CO2+Ca2++2OH-═CaCO3↓+H2O;
(5)Cu2++2OH-=Cu(OH)2↓表示可溶性铜盐与强碱反应生成氢氧化铜沉淀和可溶性盐,可以表示硫酸铜与氢氧化钠反应的离子方程式,该反应化学方程式为:Cu SO4+2NaOH=Cu(OH)2↓+Na2SO4;
故答案为:Cu SO4+2NaOH=Cu(OH)2↓+Na2SO4.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子反应必须遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.


科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在合成氨的反应中,增大压强有利于氨的合成 | |
| B. | H2、I2、HI三者的平衡混合气,加压(缩小容器体积)后颜色变深 | |
| C. | 新制的氯水在光照下颜色变浅 | |
| D. | 氯气可以用排饱和食盐水的方法收集(Cl2+H2O═HCl+HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀锌铁皮的镀层损坏后,铁更容易腐蚀 | |
| B. | 镀锡铁皮的镀层损坏后,铁更容易腐蚀 | |
| C. | 金属腐蚀就是金属原子失去电子被还原的过程 | |
| D. | 钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色试液加入Na2CO3溶液产生白色沉淀,结论:试液中含Ca2+ | |
| B. | 无色试液加入KOH溶液,加热产生的气体使湿润红色石蕊试纸变蓝,结论:试液中含NH4Cl | |
| C. | 无色试液使红色石蕊试纸变蓝,结论:试液呈碱性 | |
| D. | 无色试液焰色反应呈紫色,结论:试液是钾盐溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
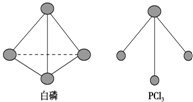 白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别加入碘水,观察颜色反应 | B. | 分别加热,观察是否生成沉淀 | ||
| C. | 加入淀粉酶观察是否水解 | D. | 分别加入KI溶液,观察颜色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com