
【题目】冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或氢气或一氧化碳)法;③活泼金属置换法;④电解法。四种方法在工业上均有应用,古代有⑴火烧孔雀石炼铜;⑵湿法炼铜;现代有⑶铝热法炼铬;⑷从光卤石(KCl·MgCl2·6H2O)中炼镁。对它们的冶炼方法的分析不正确的是
A. ⑴用① B. ⑵用② C. ⑶用③ D. ⑷用④
科目:高中化学 来源: 题型:
【题目】实验室用浓盐酸与二氧化锰固体加热反应来制备氯气(MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O),某兴趣小组制取氯气并进行氯气的性质实验装置如图,请回答下列问题:
MnCl2+Cl2↑+2H2O),某兴趣小组制取氯气并进行氯气的性质实验装置如图,请回答下列问题: 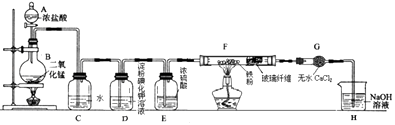
(1)仪器A的名称是 .
(2)C中反应的化学方程式为 , 所得溶液除水分子外,还含有的分子和离子中正确的是 .
A.Cl2、HCl、HClO,H+、Cl﹣ B.Cl2、Mn2+、HClO,H+、Cl﹣
C.Cl2、HClO,H+、Cl﹣、ClO﹣ D.Cl2、HCl、HClO,H+、Mn2+
(3)实验中观察到D溶液变蓝色,查资料得知淀粉碘化钾溶液是淀粉和碘化钾(KI)的混合溶液,碘单质(I2)遇淀粉显蓝色,且氯气可以从KI中置换出碘单质,写出该反应的化学方程式为 .
(4)F中氯气与铁粉反应制备无水三氯化铁,查资料知该化合物呈棕红色、易吸水潮解,100℃左右时升华.E中浓硫酸的作用是 , 双通管F中玻璃纤维(不参与反应)的作用是 .
(5)H中盛有NaOH溶液,其作用是 , 发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是冶炼铜及制备铁氧化物的重要矿藏,常含有微量金、银等。下图是以黄铜矿为主要原料生产铜、铁红(氧化铁)颜料的工艺流程图:

(1)CuCl难溶于水,但可与过量Cl-反应生成可溶于水的[CuCl2]-,该反应的离子方程式为________________________________。
(2)有大量Cl-存在时,Na2SO3可将CuCl2还原成[CuCl2]-,因此Na2SO3要缓慢滴入到溶液中的原因是_______________________________。
(3)反应IV中,属于非氧化还原反应的是反应_______________________。
(4)已知反应V中Cu+发生自身氧化还原反应,歧化为Cu2+和Cu,由此可推知溶液A中的溶质为________________(填化学式)。
(5)在酸性、有氧条件下,一种叫做Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程中发生反应的离子方程式为_____________________________。
(6)将一定量铁红溶于160 mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束后共收集气体2.24L(标准状况下),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为_____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用元素周期律解释的是
A. Mg、Al与同浓度盐酸反应,Mg更剧烈 B. 向Na2SO3溶液中加盐酸,有气泡产生
C. 0.1 mol·L-1 溶液的碱性:MaOH>LiOH D. 气态氢化物的稳定性:HBr>HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由H、Na、Mg、S、O、Cl六种元素组成的物质,按要求,每小题各写出一个化学方程式
(1)是化合反应又是氧化还原反应的 .
(2)是分解反应又是氧化还原反应的 .
(3)是氧化还原反应又是置换反应的 .
(4)写出酸性氧化物与可溶性碱反应的化学方程式 .
(5)写出碱性氧化物与水反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向59.2g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0mol/L的NaOH溶液2.8L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g。下列有关说法错误的是 ( )
A. Fe2O3和FeO的物质的量之比为1:6
B. 硝酸的物质的量浓度为3.0mol/L
C. 产生的NO在标准状况下的体积为4.48L
D. Fe2O3和FeO与硝酸反应后剩余0.2molHNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,①pH=1的氨水;②pH=11的NaOH溶液;③pH=3的醋酸;④pH=3的硫酸;下列有关说法不正确的是
A. ①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B. 分别加水稀释10倍,四种溶液的pH ①>②>③>④
C. ①、④两溶液混合后,若溶液呈中性,则所得溶液中c(NH4+)=2c(SO42-)
D. V1 L④与V2 L②溶液混合后,若混合后溶液pH=4,则V1∶V2= 11∶9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 活化分子间的碰撞一定能发生化学反应
B. 升高温度时,化学反应速率加快,主要原因是反应物分子的能量增加,活化分子百分数增大,单位时间内有效碰撞次数增多
C. 自发进行的反应一定迅速
D. 凡是熵增加的过程都是自发过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com