
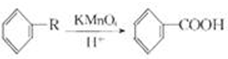
 ,
,
 +2CH3COOH$→_{△}^{浓硫酸}$
+2CH3COOH$→_{△}^{浓硫酸}$ +2H2O.
+2H2O.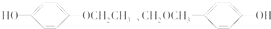 、
、 、
、 .
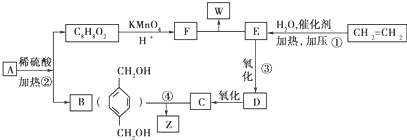
. 分析 乙烯与水发生加成反应生成E为CH3CH2OH,E发生氧化反应生成D为CH3CHO,D进一步氧化生成C为CH3COOH;B和C按1:2发生酯化反应生成Z为 ,A水解得到C8H8O2与B,可推知A含有酯基,C8H8O2中含-COOH,且能被酸性高锰酸钾溶液溶液氧化得到F,F和E按1:2反应生成W,则F为二元羧酸,故C8H8O2为
,A水解得到C8H8O2与B,可推知A含有酯基,C8H8O2中含-COOH,且能被酸性高锰酸钾溶液溶液氧化得到F,F和E按1:2反应生成W,则F为二元羧酸,故C8H8O2为 ,F为
,F为 ,W为
,W为 ,A为
,A为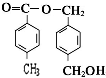 ,据此分析解答.
,据此分析解答.
解答 解:乙烯与水发生加成反应生成E为CH3CH2OH,E发生氧化反应生成D为CH3CHO,D进一步氧化生成C为CH3COOH;B和C按1:2发生酯化反应生成Z为 ,A水解得到C8H8O2与B,可推知A含有酯基,C8H8O2中含-COOH,且能被酸性高锰酸钾溶液溶液氧化得到F,F和E按1:2反应生成W,则F为二元羧酸,故C8H8O2为
,A水解得到C8H8O2与B,可推知A含有酯基,C8H8O2中含-COOH,且能被酸性高锰酸钾溶液溶液氧化得到F,F和E按1:2反应生成W,则F为二元羧酸,故C8H8O2为 ,F为
,F为 ,W为
,W为 ,A为
,A为 ,
,
(1)通过以上分析知,该反应是加成反应,故答案为:加成反应;
(2)F为 ,一个F分子中含有两个羧基,羧基和NaOH以1:1反应,所以1molF最多能和2molNaOH反应,故答案为:2;
,一个F分子中含有两个羧基,羧基和NaOH以1:1反应,所以1molF最多能和2molNaOH反应,故答案为:2;
(3)B和C按1:2发生酯化反应生成Z为 ,反应方程式为
,反应方程式为 +2CH3COOH$→_{△}^{浓硫酸}$
+2CH3COOH$→_{△}^{浓硫酸}$ +2H2O,
+2H2O,
故答案为: +2CH3COOH$→_{△}^{浓硫酸}$
+2CH3COOH$→_{△}^{浓硫酸}$ +2H2O;
+2H2O;
(4)B为 ,与B互为同分异构体,属于酚类说明含有酚羟基,苯环上只有两个对位取代基的化合物有4种,剩余两种同分异构体为
,与B互为同分异构体,属于酚类说明含有酚羟基,苯环上只有两个对位取代基的化合物有4种,剩余两种同分异构体为 、
、 ,
,
故答案为: 、
、 .
.
点评 本题考查有机物推断,侧重考查学生分析推断能力,以乙烯为突破口采用正逆结合的方法进行推断,注意题给信息的灵活运用,难点是(4)题同分异构体的判断,要考虑碳链异构,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Al3+、H+、AlO2-、Cl- | B. | Cu2+、Fe2+、ClO-、SO42- | ||
| C. | Na+、Ca2+、HCO3-、Cl- | D. | Cu2+、Fe3+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.653 | 42.875 |
| A | B | C | D | |
| n(Fe2O3) | 0.350 | 0.027 | 0.080 | 0.080 |
| n(CO) | 0.010 | 0.010 | 0.010 | 0.050 |
| n(Fe) | 0.100 | 0.064 | 0.080 | 0.080 |
| n(CO2) | 0.035 | 0.088 | 0.040 | 0.050 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
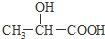 )和乙醇的混合物共1mol,完全燃烧生成54g水和56L(标准状况下测定)CO2,则完全燃烧时消耗氧气物质的量是( )
)和乙醇的混合物共1mol,完全燃烧生成54g水和56L(标准状况下测定)CO2,则完全燃烧时消耗氧气物质的量是( )| A. | 2 mol | B. | 2.25 mol | C. | 3 mol | D. | 3.75 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | HCl | C. | H2SO4 | D. | KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18.4mol/L 硫酸 10mL | B. | 2mol/L 硫酸 10mL | ||
| C. | 1mol/L 硫酸 30mL | D. | 3mol/L 盐酸 10mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .9g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是22.4L,如果与足量的小苏打溶液完全反应产生的气体在标准状况下的体积是22.4L.
.9g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是22.4L,如果与足量的小苏打溶液完全反应产生的气体在标准状况下的体积是22.4L.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com