
| c(NH4+) |
| c(OH-) |
| c(NH4+) |
| c(OH-) |


科目:高中化学 来源: 题型:
| A、可以用饱和溴水除去苯中混有的苯酚 |
| B、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| C、中和滴定时,应用待测液润洗滴定管和锥形瓶 |
| D、做完铜和浓硫酸反应的大试管实验结束时要立即往试管中加水清洗,这样可以减少尾气的产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
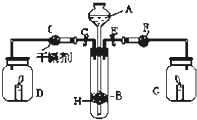 为证明有关物质的性质,某学生设计了如图所示的装置.当打开活塞C,使液体A与隔板H上的固体B相遇时,即有气体产生,并发现D中蜡烛熄灭;关闭C 打开E时,则看到G中蜡烛燃得更亮,且F中盛放固体为淡黄色.
为证明有关物质的性质,某学生设计了如图所示的装置.当打开活塞C,使液体A与隔板H上的固体B相遇时,即有气体产生,并发现D中蜡烛熄灭;关闭C 打开E时,则看到G中蜡烛燃得更亮,且F中盛放固体为淡黄色.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol?L-1的K2SO4溶液中有2NA个K+ |
| B、1mol Cl2与足量铁反应,转移2NA个电子 |
| C、标准状况下,22.4L氨气溶于水,此溶液中含有NA个NH3分子 |
| D、所含溶质为63g的浓硝酸与足量的铜反应,生成的气体分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com