
【题目】在某密闭容器中,发生如下反应:2NO(g)+O2(g) ![]() 2NO2(g) △H<0 。下列研究目的和示意图相符的是( )
2NO2(g) △H<0 。下列研究目的和示意图相符的是( )
A | B | C | D | |
目的 | 压强对反应的影响(P1>P2) | 温度对反应的影响 | 平衡体系增加O2对反应的影响 | 催化剂对反应的影响 |
图示 |
|
|
|
|
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理来解释的是
A. 实验室采用排饱和食盐水的方法收集氯气Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
B. 工业上合成氨反应N2(g)+ 3H2 (g)![]() 2NH3(g) △H<0 选择500 ℃
2NH3(g) △H<0 选择500 ℃
C. H2、I2、HI平衡混合气体加压后颜色加深H2(g)+ I2(g)![]() 2HI(g)
2HI(g)
D. SO2氧化成SO3,往往需要使用催化剂2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是

A. b是阴离子交换膜,允许Na+通过
B. 从A口出来的是H2SO4溶液
C. 阴极反应式为 4OH--4e-=2H2O+O2↑
D. Na2SO4溶液从G口加入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A.所有酯类和糖类都可以发生水解反应
B.分馏石油得到的各个馏分都是混合物
C.棉花和蚕丝的主要成分都是纤维素
D.动物脂肪和植物油都属于酯类,都是高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①:CO(g)+CuO(s) ![]() CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) ![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g) ![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=![]()
B. 反应③的平衡常数K=![]()
C. 对于反应③,恒容时,温度升高,H2的浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2的浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 0.1mol/LpH为4的NaHB溶液中:c (HB-)>c(H2B)>c(B2-)
B. 如图表示25℃时,用0.1mol·L-1盐酸滴定20mL0.1mol·L-1NaOH溶液时,溶液的pH随加入酸体积的变化

C. 在pH=2的NaHSO4溶液中c(H+)=c(OH-)+ c(SO42-)
D. pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示,分别滴加NaOH溶液(c=0.1mol·L-1)至pH=3,消耗NaOH溶液的体积为Vx、Vy,则x为强酸,y为弱酸且Vx>Vy

查看答案和解析>>
科目:高中化学 来源: 题型:
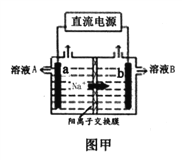
【题目】电化学原理在工业生产、生活中有重要的作用
(1)图甲是工业上用惰性电极电解饱和食盐水的原理示意图,a电极为_______极,电极反应式为________,溶液B为_______溶液,电解总反应的离子方程式为_____________.标况下生成33.6Cl2,通过离子交换膜的Na+物质的量为__________.
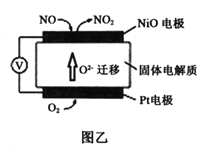
(2)通过NO传感器可检测NO的质量,其工作原理示意图如图乙。Pt电极上发生的是_________反应(填“氧化”或“还原”);写出NiO电极的电极反应式是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com