
| 1H 氢 |
 |
2He 氦 | ||||||
| 3Li 锂 |
4Be 铍 |
5B 硼 |
6C 碳 |
7N 氮 |
8O 氧 |
9F 氟 |
10Ne 氖 | |
| llNa 钠 |
12Mg 镁 |
13A1 铝 |
14Si 硅 |
15P 磷 |
16S 硫 |
XC1 氯 |
18Ar 氩 | |
| 19K 钾 |
20Ca 钙 |
… | ||||||
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
查看答案和解析>>
科目:高中化学 来源:必修二训练化学苏教版 苏教版 题型:022
历史上,为了寻求各种元素及其化合物间的内在联系和规律性,许多人进行了各种尝试.1869年________国化学家________在前人探索的基础上发现了元素周期律,从而加速了化学科学发展的进程.元素周期表是学习和研究化学的重要工具,它的内容十分丰富.下表给出了1-18号元素在周期表中的位置.
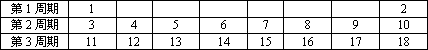
(1)原子序数为17的元素名称是________,在化学反应中,该元素的原子容易________(填“得”或“失”)电子;原子序数为13的元素属于________(填“金属”或“非金属”)元素.
(2)对上表进行研究,可以发现如下规律:
①原子序数与元素原子的核电荷数在数值上相等;
②________;
③________.
查看答案和解析>>
科目:高中化学 来源:2014届山东省文登市高三上学期期中统考理综化学试卷(B)(解析版) 题型:填空题
元素周期表是学习和研究化学的重要工具。按要求回答下列问题:
A、B、C、D、E是短周期元素,其原子序数依次增大。A、C两元素的最外层只有一个电子,C离子的电子层结构与周期表中非金属性最强的元素的阴离子的电子层结构相同;元素A可以和B形成A2B和A2B2两种分子;化合物甲和乙的每个分子中均含有5个原子,甲是由元素D与A组成,其分子的核外电子总数为18,乙是由元素D与E组成;化合物丙是由C与E组成的。
(1)元素B、D、E的元素符号依次为_______、_______、______。
(2)上述5种元素形成的分子中,除甲分子外,核外电子总数也为18的有___(填分子式)
(3)D的氧化物在高温下可以与C的碳酸盐发生反应,其化学反应方程式为________;化合物乙遇水剧烈反应有白雾生成,其反应的化学方程式为___________。
(4)用500mL容量瓶配制400mL 1mol/L的丙溶液,需要丙的质量为________;配制过程中除用到容量瓶外,还需要的玻璃仪器有___________________。电解所配制的400mL溶液,当电路中通过1mol电子时,理论上可收集到的气体在标准状况下的体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
第1周期 | 1 |
|
|
|
|
|
| 2 |
第2周期 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
第3周期 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
(1)原子序数为 17的元素名称是_____________,在化学反应中,该元素的原子容易_____________(填“得”或“失”)电子;原子序数为 13的元素属于_____________(填“金属”或“非金属”)元素。
(2)对上表进行研究,可以发现如下规律:
①原子序数与元素原子的核电荷数在数值上相等;
②_________________________________________________________________;
③__________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com