
| A. | Na2CO3、NaHCO3两种盐溶液中,离子种类相同 | |
| B. | 物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者 | |
| C. | 某物质的水溶液中由水电离出的c(H+)=1×10-amol/L,若a>7,则该溶液的pH为a或14-a | |
| D. | 相同温度下,0.2mol/L的醋酸溶液与0.1mol/L的醋酸溶液中c(H+)之比大于2:1 |
分析 A、碳酸钠和碳酸氢钠溶液中的离子类型相同;
B、硫酸氢铵中铵根离子的水解收到氢离子的抑制;
C、某溶液中水溶液中由水电离出的c(H+)=1×10-amol/L,若a>7,说明该物质抑制水电离,则该物质的水溶液呈酸性或碱性;
D、相同温度下的醋酸溶液中,醋酸浓度越大,醋酸的电离程度越小.
解答 解:A、碳酸钠和碳酸氢钠溶液中的离子类型相同,都含有钠离子、氢离子、氢氧根离子、碳酸根离子、碳酸氢根离子、碳酸分子和水分子,故A正确
B、硫酸氢铵中铵根离子的水解收到氢离子的抑制,物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者,故B正确;
C、某溶液中水溶液中由水电离出的c(H+)=1×10-amol/L,若a>7,说明该物质抑制水电离,则该物质的水溶液呈酸性或碱性,如果溶液呈酸性,溶液中c(OH-)=c(H+)(水电离的)=1×10-amol/L,则溶液的pH=14-a,如果溶液呈碱性,溶液中氢离子浓度就是水电离出的氢离子浓度,则溶液的pH=a,故C正确;
D、醋酸是弱电解质,相同温度下,醋酸的浓度越大其电离程度越小,所以0.2mol/L的醋酸溶液与0.1mol/L的醋酸溶液中c(H+)之比小于2:1,故D错误;
故选D.
点评 本题考查离子浓度大小比较及酸碱混合溶液的定性判断,题目难度中等,根据电荷守恒和物料守恒来分析解答,注意相同温度下,弱电解质的浓度与电离程度的关系,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 四种元素的原子半径:Z<Y<X<W | |
| B. | 化合物Z3X与ZX3中的化学键类型相同 | |
| C. | X与W两种元素的最简单氢化物间能发生化合反应 | |
| D. | 常温下,X和Y形成的所有单质均为无色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常情况下,1.5molO2的体积约为33.6L | |
| B. | NaOH的摩尔质量是40g | |
| C. | 100 mL水中溶解5.85gNaCl所得NaCl溶液的物质的量浓度为1 mol•L-1 | |
| D. | 任何条件下,等物质的量的水和一氧化碳所含有的分子数必相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 25℃,1.01×105Pa,64gSO2中含有的分子数为3NA | |
| C. | 标准状况下,11.2LCl2含有的分子数小于0.5NA | |
| D. | 在常温常压下,11.2LCCL4含有的分子数小于0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂,在单位时间内提高合成氨产率 | |
| B. | 对于2HI(g)?H2(g)+2CO(g),达平衡后.缩小容器体积可使体系颇色变深 | |
| C. | 对于2CaO2(s)?2CaO(s)+O2(g),达平衡后增大压强,再次平衡后O2的浓度保持不变 | |
| D. | 溴水中有下列平衡:Br(aq)+H2O(l)?HBr(aq)+HBrO(aq)当加入硝酸银溶液后,溶液颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在吸热反应中,反应物的总能量高于生成物的总能量 | |
| D. | 需要加热的化学反应一定是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
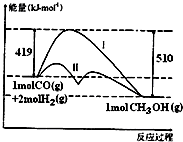 对于反应CO(g)+2H2(g)?CH3OH(g)△H,反应过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )
对于反应CO(g)+2H2(g)?CH3OH(g)△H,反应过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )| A. | 该反应的△H=+91kJ/mol | |
| B. | 加入催化剂,该反应的△H变小 | |
| C. | 反应物的总能量大于生成物的总能量 | |
| D. | 如果该反应生成液态CH3OH时为△H1,则△H1>△H |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com