
| A. | Na2O与Na2O2中阳离子和阴离子的个数比分别为2:1和1:1 | |
| B. | Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀 | |
| C. | Na2CO3溶液能与Ca(OH)2反应产生白色沉淀,而NaHCO3溶液不能 | |
| D. | Na2O2可作供氧剂,而Na2O不行 |
分析 A、Na2O2的电子式为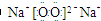 ,阴、阳离子的个数比为1:2;
,阴、阳离子的个数比为1:2;
B、Na2CO3溶液和CaCl2溶液反应,NaHCO3溶液和CaCl2溶液不反应;
C、Na2CO3溶液能与Ca(OH)2反应产生白色沉淀,NaHCO3溶液也能;
D、Na2O2可作氧气的来源,但是氧化钠不行.
解答 解:A、Na2O2的电子式为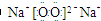 ,阳离子和阴离子的个数比分别为2:1,Na2O阳离子和阴离子的个数比分别为2:1,故A错误;
,阳离子和阴离子的个数比分别为2:1,Na2O阳离子和阴离子的个数比分别为2:1,故A错误;
B、Na2CO3溶液和CaCl2溶液反应产生白色沉淀,NaHCO3溶液和CaCl2溶液不反应,故B错误;
C、Na2CO3溶液能与Ca(OH)2反应产生白色沉淀,NaHCO3溶液也能与Ca(OH)2反应产生白色沉淀,故C错误;
D、Na2O2可和水以及二氧化碳反应产生氧气,作氧气的来源,但是氧化钠不行,故D正确.
故选D.
点评 本题考查学生氧化钠、过氧化钠性质的差异,注意过氧化钠和氧化钠中微粒的区别是关键,难度中等.


科目:高中化学 来源: 题型:选择题

| A. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数分别为增大和减小 | |
| B. | 保持温度和活塞位置不变,在甲中再加入1mol A和2mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率 变化已省略) | |
| D. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 电极材料 | 电解质溶液 | 电液计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
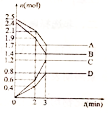 在某一容积为2 L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间 t(min)的变化曲线如图所示,回答下列问题:
在某一容积为2 L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间 t(min)的变化曲线如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有硫酸铜水溶液的试管里,现象为开始生成蓝色沉淀,后蓝色沉淀溶解,得到深蓝色的透明溶液.
;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有硫酸铜水溶液的试管里,现象为开始生成蓝色沉淀,后蓝色沉淀溶解,得到深蓝色的透明溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$v(CO)=v(NO2) | B. | $\frac{1}{2}$v(NO2)=v(CO2) | C. | $\frac{1}{4}$v(N2)=v(CO2) | D. | $\frac{1}{4}$v(N2)=v(CO) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com