

| A. | CCl4起到萃取、富集I2的作用 | |
| B. | a中下层变无色,说明I2 转化为I- | |
| C. | Ⅲ中发生反应的离子方程式为:Br2+2I-═I2+2Br- | |
| D. | 只依据a、b中现象,不可以证明Cl2的氧化性比 Br2强 |
分析 A、碘单质和四氯化碳都是非极性分子,根据相似相溶的原理分析解答;
B、四氯化碳不溶于水,比水重,碘单质在四氯化碳中溶解度大于水中,四氯化碳层为紫红色,上层为主要溶质是氯化钾;
C、溴单质的氧化性强于碘单质,所以溴单质能将碘离子氧化成碘单质;
D、Ⅱ滴入氯水能将碘单质氧化成无色的碘酸根离子,而Ⅳ滴入溴水下层仍呈紫色.
解答 解:A、碘单质和四氯化碳都是非极性分子,下层呈紫色,所以CCl4起到萃取、富集I2的作用,故A正确;
B、四氯化碳不溶于水,比水重,碘单质在四氯化碳中溶解度大于水中,四氯化碳层为紫红色,上层为主要溶质是氯化钾,而不是将I2 转化为I-,故B错误;
C、溴单质的氧化性强于碘单质,所以溴单质能将碘离子氧化成碘单质,发生了Br2+2I-═I2+2Br-,故C正确;
D、Ⅱ滴入氯水能将碘单质氧化成无色的碘酸根离子,而Ⅳ滴入溴水下层仍呈紫色,所以氯气的氧化性强于溴单质,故D错误;
故选BD.
点评 本题以碘的提取为载体综合考查物质的分离、提纯,为高考常见题型,侧重于学生的分析、实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
(1)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当 pH=7 时,若 V1=V2,则一定是 c2>c1 | |
| B. | 在任何情况下都满足 c(Na+ )+c(H+ )=c(CH3COO- )+c(OH- ) | |
| C. | 若 pH>7,则一定是 c1V1>c2V2 | |
| D. | 若 V1=V2,c1=c2,则 c(CH3COO-)+c(CH3COOH)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78g Na2O2与足量水充分反应时电子转移数为2NA | |
| B. | 25℃、101.3kPa时,11.2L H2中含有的原子数为NA | |
| C. | 4℃、101.3kPa时,54mL H2O中含有的分子数为3NA | |
| D. | 2L 1mol/L Na2SO4溶液中离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用丁达尔现象区分溶液和胶体 | |
| B. | 硅是良好的半导体材料,纯净二氧化硅是光导制品的基本原料 | |
| C. | SO2 使高锰酸钾褪色是利用 SO2 的漂白性 | |
| D. | 定容时俯视刻度线,会导致浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
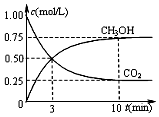 燃煤技术的改进,有助于合理控制温室效应、环境污染,并能进行资源化利用,还可重新获得燃料或重要工业产品.工业上以煤和水为原料通过一系列转化变为清洁能源氢气和工业原料甲醇.
燃煤技术的改进,有助于合理控制温室效应、环境污染,并能进行资源化利用,还可重新获得燃料或重要工业产品.工业上以煤和水为原料通过一系列转化变为清洁能源氢气和工业原料甲醇.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com