
| A. | 能够发生化学反应的碰撞是有效碰撞 | |
| B. | 活化分子之间的碰撞一定是有效碰撞 | |
| C. | 反应物分子的每次碰撞都能发生化学反应 | |
| D. | 增大反应物浓度时,活化分子百分数增大 |
分析 A.能够发生化学反应的碰撞是有效碰撞,有效碰撞的条件:①活化分子,②有合适的取向;
B.活化分子之间发生的碰撞不一定是有效碰撞;
C.反应物分子的每次碰撞不一定都发生化学反应;
D.增大反应物浓度时,增大单位体积内活化分子个数.
解答 解:A.能够发生化学反应的碰撞是有效碰撞,有效碰撞的条件:①活化分子,②有合适的取向,所以只有活化分子的有效碰撞才能发生化学反应,故A正确;
B.活化分子之间发生的碰撞不一定是有效碰撞,只有发生化学反应的碰撞才是有效碰撞,故B错误;
C.反应物分子的每次碰撞不一定都发生化学反应,可能是无效碰撞,故C错误;
D.增大反应物浓度时,增大单位体积内活化分子个数,但活化分子百分数不变,故D错误;
故选A.
点评 本题考查化学反应基本原理,侧重考查基本概念及基本理论,活化分子、有效碰撞等概念都较抽象,为学习难点.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 当前环境问题,如酸雨、温室效应、臭氧层破坏、光化学烟雾、有毒物质的污染等,已成为世界各国普遍关注和研究的问题.请回答:
当前环境问题,如酸雨、温室效应、臭氧层破坏、光化学烟雾、有毒物质的污染等,已成为世界各国普遍关注和研究的问题.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将固体CuO加入稀H2SO4中 CuO+2H+=Cu2++H2O | |
| B. | 盐酸滴加在石灰石上 CaCO3+2H+=Ca2++H2CO3 | |
| C. | Ba(OH)2溶液与稀硫酸混合 Ba2++SO42-=BaSO4↓ | |
| D. | 铜片加入稀盐酸中 Cu+2H+=Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
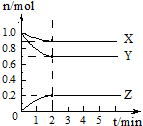 某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间变化曲线如图所示,由图中数据分析,该反应的化学方程式为X+3Y?2Z,反应开始至2min,反应的平均速率v(Z)=0.05mol•L-1•min-1.
某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间变化曲线如图所示,由图中数据分析,该反应的化学方程式为X+3Y?2Z,反应开始至2min,反应的平均速率v(Z)=0.05mol•L-1•min-1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ②③⑦ | C. | ①⑥ | D. | ②④⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com