
【题目】曲美替尼是一种抑制黑色素瘤的新型抗癌药物,下面是合成曲美替尼中间体G的反应路线:
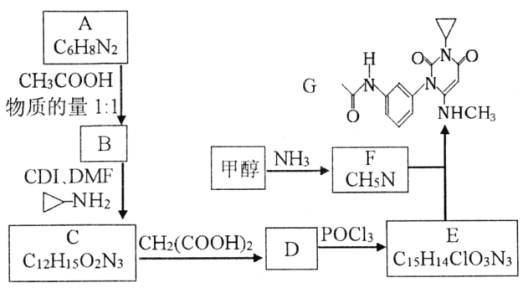
已知:①D分子中有2个6元环;
请回答:
(1)化合物A的结构简式___________。A生成B的反应类型___________。
(2)下列说法不正确的是___________。
A.B既能表现碱性又能表现酸性
B.1moC在碱溶液中完全水解最多可以消耗4 molOH-
C.D与POCl3的反应还会生成E的一种同分异构体
D.G的分子式为C16H18O3N4
(3)写出C→D的化学方程式____________________________________________。
(4)X是比A多2个碳原子的A的同系物,写出符合下列条件的X可能的结构简式:_______________________________________________________。
①1H-NMR谱显示分子中有3种氢原子,②IR谱显示分子中有苯环与-NH2相连结构
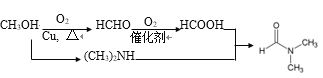
(5)流程中使用的DMF即N,N-二甲基甲酰胺结构简式为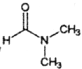 ,是常用的有机溶剂。设计以甲醇和氨为主要原料制取DMF的合成路线(用流程图表示,其他无机试剂任选)。_____________
,是常用的有机溶剂。设计以甲醇和氨为主要原料制取DMF的合成路线(用流程图表示,其他无机试剂任选)。_____________
【答案】![]() 取代反应 AB
取代反应 AB ![]() +CH2(COOH)2→
+CH2(COOH)2→ +2H2O
+2H2O 
【解析】
甲醇与氨气发生取代反应生成CH3NH2(F),F与E发生取代反应生成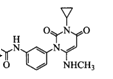 ,所以有机物E为
,所以有机物E为 ,根据反应条件,有机物D与 POCl3反应生成
,根据反应条件,有机物D与 POCl3反应生成 ,所以有机物(D)
,所以有机物(D)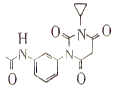 ,有机物C与CH2(COOH)2反应生成有机物D,所以有机物C为
,有机物C与CH2(COOH)2反应生成有机物D,所以有机物C为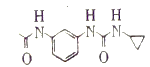 ;有机物B与
;有机物B与![]() 发生反应生成有机物C,所以有机物B为
发生反应生成有机物C,所以有机物B为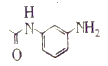 ,有机物A与醋酸反应生成有机物B,所以有机物A为
,有机物A与醋酸反应生成有机物B,所以有机物A为![]() ;据以上分析解答。
;据以上分析解答。
(1)根据以上分析可知,化合物A的结构简式![]() ;
;
(2)A.有机物B为 ,含有氨基,显碱性,肽键显中性,没有酸性,选项A错误;
,含有氨基,显碱性,肽键显中性,没有酸性,选项A错误;
B.1mol有机物C( )在碱溶液中完全水解最多可以消耗2molOH-,选项B错误;
)在碱溶液中完全水解最多可以消耗2molOH-,选项B错误;
C.D与POCl3的反应生成 外,还能生成E的一种同分异构体
外,还能生成E的一种同分异构体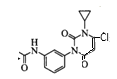 ,选项C正确;
,选项C正确;
D.根据有机物G的结构简式,其分子式为C16H18O3N4,选项D正确;
答案选AB;
(3)有机物C为 与CH2(COOH)2反应生成有机物D,化学方程式:
与CH2(COOH)2反应生成有机物D,化学方程式: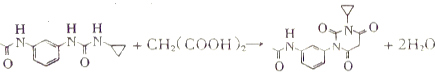 ;
;
(4)有机物A为![]() ;X是比A多2个碳原子的A的同系物,Xspan>一定含有两个氨基,碳原子数为8的有机物,①1H-NMR谱显示分子中有3种氢原子,IR谱显示分子中有苯环与—NH2相连结构,满足条件的有机物的结构简式为:
;X是比A多2个碳原子的A的同系物,Xspan>一定含有两个氨基,碳原子数为8的有机物,①1H-NMR谱显示分子中有3种氢原子,IR谱显示分子中有苯环与—NH2相连结构,满足条件的有机物的结构简式为: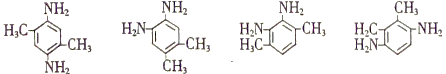 ;
;
(5)甲醇氧化为甲醛,接着氧化为甲酸;根据信息,甲醇与氨气反应生成(CH3)2NH,甲酸与(CH3)2NH发生取代生成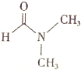 ;合成流程如下:
;合成流程如下: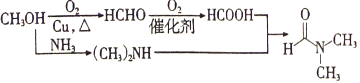 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用●标注。下列说法正确的是( )
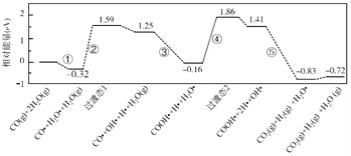
A.水煤气变换反应的△H<0
B.步骤③的化学方程式为:CO●+OH●+H2O(g)=COOH●+H2O●
C.步骤⑤只有非极性键H﹣H键形成
D.该历程中最大能垒(活化能)E正=1.70eV
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示物质A~F之间的转化关系,其中A为淡黄色固体物质,B、C为无色溶液,D为气体,E、F为白色沉淀。请填写下列各空:
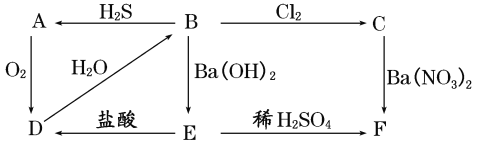
(1)写出各物质的化学式:
A为______,B为_____,C为_____,D为_____,E为_____,F为______。
(2)写出下列反应的化学方程式:
B→A:________________________。
B→C:___________________________。
(3)写出C→F的离子方程式:___________________。
(4)在A~F六种物质中,既有氧化性又有还原性的是(填字母代号)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是室温下,几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb):
酸或碱 | 电离常数(Ka或Kb) |
CH3COOH | Ka=1.75×10-5 |
柠檬酸(H3C6H5O7) | Ka1=7.4×10-4 Ka2=1.73×10-5 Ka3=4.0×10-7 |
NH3·H2O | Kb=1.75×10-5 |
请回答下列问题:
(1)用蒸馏水稀释0.1 mol/L的醋酸溶液,下列选项中一定变小的是__________(填字母)。
A.![]()
B.c(H+)
C.c(OH-)·c(H+)
D.![]()
E.![]()
(2)浓度为0.10 mol/L柠檬酸氢二钠(Na2HC6H5O7)溶液显_____(填“酸”“碱”或“中”)性,通过计算说明其原因____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25°C时,若向a mol·L-1的HA溶液中,滴加等体积的b mol·L-1的NaOH溶液,使溶液呈中性,用含a的代数式表示HA的电离平衡常数Ka=____________。
(2)25°C时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应完后溶液中c(NH4+)=c(Cl-),则溶液显_____性(填“酸”、“碱”或“中”),用含a的代数式表示NH3·H2O的电离平衡常数Kb=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:
实验编号 | c(HA)/ mol·L-1 | c(NaOH)/ mol·L-1 | 反应后溶液pH |
甲 | 0.1 | 0.1 | pH=9 |
乙 | c1 | 0.2 | pH=7 |
下列判断不正确的是
A.c1一定大于0.2 mol·L-1
B.HA的电离方程式是HA![]() H++A-
H++A-
C.甲反应后溶液中:c(Na+) > c(OH-)> c(A-) > c(H+)
D.乙反应后溶液中:c(Na+) < c(HA)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列关于N及其化合物的问题:
(1)配制Fe(NO3)2溶液时可否加入少量HNO3抑制Fe2+水解?_______,原因是__________________________________________。
(2)汽车尾气中含有大量NO2,会导致环境污染,在汽车尾气管装上电化学转化装置在碱性水溶液环境中形成原电池,可部分解除NO2的污染,则该装置的正极反应方程式为_________________________________;该装置的负极原料为NH3,当电路中转移8mole-时,负极消耗NH3的质量理论值约为________,(保留小数点后一位小数)实际上消耗NH3的量远大于该理论值的原因可能为_________________________________________。
(3)NaOH溶液也可解除NO2的污染,该反应的化学方程式为_____________________________。
(4)第(3)问反应可产生致癌物质NaNO2,该物质中N元素的化合价为_____价,酸性环境中的NaNO2可用H2O2氧化处理,处理过程的离子方程式为___________________,若改用O2来氧化,则68g的H2O2相当于O2的质量为____;(保留小数点后一位小数)使用H2O2作为氧化剂的优点是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮及其化合物对化工生产有重要意义。
(1)已知:
①N2(g)+O2(g)=2NO(g) △H1
②2NH3(g)![]() N2(g)+3H2(g) △H2
N2(g)+3H2(g) △H2
③2H2(g)+O2(g)=2H2O(g) △H3
则热化学方程式:4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=_____(用△H1,△H2,△H3表示)。
(2)在2L密闭绝热容器中,投入4molN2和6molH2,在一定条件下生成NH3,测得不同温度下,平衡时NH3的物质的量数据如下表:
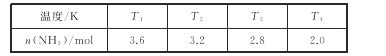
①下列能说明该反应已达到平衡状态的是_____。
A.3v正(H2)=2v逆(NH3)
B.容器内气体压强不变
C.混合气体的密度不变
D.混合气的温度保持不变
②温度T1_____(填“>”<”或“=”)T3。
③在T4温度下,达到平衡时N2的转化率为_____。
(3)N2O4为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)=2NO2(g) △H。上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则该反应的化学平衡常数Kp为____(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298K、压强110kPa),已知该条件下k逆=5×102kPa-1·s-1,当N2O4分解10%时,v逆=_____kPa·s-1。
(4)以连二亚硫酸盐(S2O42-)为还原剂脱除烟气中的NO,并通过电解再生,装置如图。阴极的电极反应式为_____,电解槽中的隔膜为_____(填“阳”或“阴”)离子交换膜。每处理1molNO,电路中通过电子的物质的量为_____。
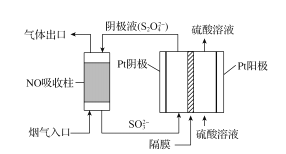
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在工农业生产中应用广泛,可由N2、H2合成NH3。
(1)天然气蒸汽转化法是目前获取原料气中H2的主流方法。CH4经过两步反应完全转化为H2和CO2,其能量变化示意图如图:
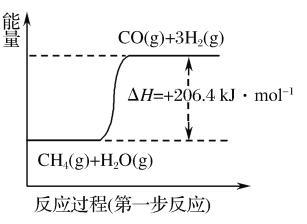

结合图象,写出CH4通过蒸汽转化为CO2和H2的热化学方程式:___。
(2)利用透氧膜,一步即获得N2、H2,工作原理如图所示(空气中N2与O2的物质的量之比按4∶1计)。
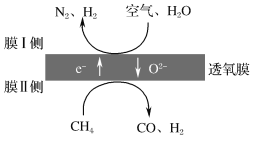
①起还原作用的物质是___。
②膜Ⅰ侧所得气体中![]() =2,CH4、H2O、O2反应的化学方程式是___。
=2,CH4、H2O、O2反应的化学方程式是___。
(3)甲小组模拟工业合成氨在一恒温恒容的密闭容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0。t1 min时达到平衡,在t2 min时改变某一条件,其反应过程如图所示,下列说法正确的是___。
2NH3(g) ΔH<0。t1 min时达到平衡,在t2 min时改变某一条件,其反应过程如图所示,下列说法正确的是___。
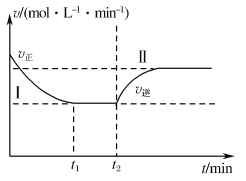
A.Ⅰ、Ⅱ两过程达到平衡时,平衡常数:KⅠ<KⅡ
B.Ⅰ、Ⅱ两过程达到平衡时,NH3的体积分数:φ(Ⅰ)<φ(Ⅱ)
C.Ⅰ、Ⅱ两过程达到平衡的标志是混合气体的密度不再发生变化
D.t2min时改变的条件可以是向密闭容器中加N2和H2的混合气
(4)乙小组模拟不同条件下的合成氨反应,向容器中充入9.0molN2和23.0molH2,不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系如图。
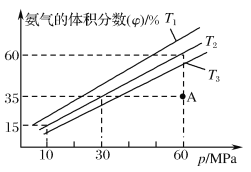
①T1、T2、T3由大到小的排序为___。
②在T2、60MPa条件下,A点v正___(填“>”“<”或“=”)v逆,理由是___。
③计算T2、60MPa平衡体系的平衡常数Kp=___MPa-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留2位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com