
| A. | CH3COOH | B. | 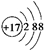 | C. | Fe3+ | D. | NH3•H2O |
分析 水的电离方程式为H2O═H++OH-,加入酸或碱能抑制水的电离,加入含有弱根离子的盐能促进水的电离,强酸强碱盐不影响水的电离,据此分析解答.
解答 解:A.醋酸溶于水后能电离出氢离子,使水的电离向左移动,所以能抑制水的电离,故A不选;
B. 为Cl-,加入Cl-后,对水的电离平衡没有影响,平衡不移动,故B选.
为Cl-,加入Cl-后,对水的电离平衡没有影响,平衡不移动,故B选.
C.加入了Fe3+,Fe3+会结合OH-,c(OH-)减小,平衡向右移动,故C不选;
D.NH3•H2O溶于水能电离出的氢氧根,使水的电离向左移动,所以能抑制水的电离,故D不选.
故选B.
点评 本题考查了水的电离,影响水的电离的因素有:温度、酸碱、含有弱根离子的盐,酸或碱能抑制水的电离,含有弱根离子的盐能促进水的电离,题目难度不大.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 2H2O2=2H2O+O2↑ | B. | 2Na+2H2O=2NaOH+H2↑ | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | 3CO+Fe2O3=2Fe+3CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无论n为多少,m不可能为奇数 | |
| B. | 1个C3HmOn可能含有3个醛基 | |
| C. | 当m=6、n=2时,该物质不可能含有两种官能团 | |
| D. | 当m=8时,该物质可以发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2 | B. | CH3CH=CH2 | C. | CH3C≡CH | D. | CH3CH=CHCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 操作及现象 | 结论 |
| A | 将pH=11的氨水稀释10倍,测得pH由11变成 10.6 | NH3•H2O?NH4++OH-的电离程度增大 |
| B | “NO2球”浸泡在热水中,颜色加深 | 2NO2(g)?N2O4(g)△H<0 |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 将固体CaSO4加入Na2CO3饱和溶液中,一段时间后,检验固体成分为CaCO3 | 同温下溶解度: CaSO4<CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用25mL碱式滴定管量取20.00mLKMnO4溶液 | |
| B. | 读取滴定管内液体的体积抑视会导致读数偏大 | |
| C. | 做中和滴定实验时,用待测液润洗锥形瓶 | |
| D. | 用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com