
 ��֪CH4��g��+2NO2��g��=CO2��g��+2H2O��g��+N2��g����1molCH4��Ӧת��8mol���ӣ�
��֪CH4��g��+2NO2��g��=CO2��g��+2H2O��g��+N2��g����1molCH4��Ӧת��8mol���ӣ�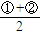 ��֪CH4��g��+2NO2��g��=CO2��g��+2H2O��g��+N2��g����H=-867kJ/mol����״����4.48LCH4�����ʵ���Ϊ0.2mol����ų�������Ϊ0.2mol×867kJ=173.4kJ����C��ȷ��
��֪CH4��g��+2NO2��g��=CO2��g��+2H2O��g��+N2��g����H=-867kJ/mol����״����4.48LCH4�����ʵ���Ϊ0.2mol����ų�������Ϊ0.2mol×867kJ=173.4kJ����C��ȷ��

 ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 | 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��2010?������һģ��һ����̼����������͵�����������Ҫ�Ļ���ԭ�ϣ���Ҳ�Ǵ�������Ҫ��Ⱦ��ۺ���������Ⱦ�ǻ�����ѧ��ǰ����Ҫ�о�����֮һ��
��2010?������һģ��һ����̼����������͵�����������Ҫ�Ļ���ԭ�ϣ���Ҳ�Ǵ�������Ҫ��Ⱦ��ۺ���������Ⱦ�ǻ�����ѧ��ǰ����Ҫ�о�����֮һ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
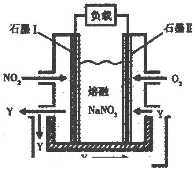
Ũ��/mol?L-1 / ʱ��/min |
NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ������ȼ������ʱ�����ĸ��»�����N2��O2������Ӧ����NO���壬�ǵ�������β���к���NO��ԭ��֮һ��
������ȼ������ʱ�����ĸ��»�����N2��O2������Ӧ����NO���壬�ǵ�������β���к���NO��ԭ��֮һ��| 1 |
| 9 |
| 1 |
| 9 |
| 1 |
| 7 |
| 1 |
| 7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
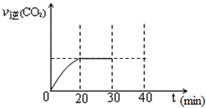 ���Ŵ�����Ⱦ���������أ��������ڡ�ʮ���塱�ڼ䣬����������SO2���ŷ�������8%���������NOx���ŷ�������10%��Ŀǰ������������Ⱦ�ж��ַ�����
���Ŵ�����Ⱦ���������أ��������ڡ�ʮ���塱�ڼ䣬����������SO2���ŷ�������8%���������NOx���ŷ�������10%��Ŀǰ������������Ⱦ�ж��ַ�����Ũ��/mol?L-1 ʱ��/min |
NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com