
实验室用标准盐酸测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是 )。
A.酸式滴定管在装液前未用标准酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.滴定前平视读数,滴定后俯视读数
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
在N2(g)+3H2(g)
 2NH3(g) ΔH<0的平衡体系中,当分离出NH3时,下列说法正确的是( )
2NH3(g) ΔH<0的平衡体系中,当分离出NH3时,下列说法正确的是( )
A.改变条件后速率—时间图象如右图:
B.此过程中Q>K
C.平衡体系中NH3的含量增大
D.N2的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的A、B两个电解池中的电极均为铂,在A池中加入0.05 mol·L-1的CuCl2溶液,B池中加入0.1 mol·L-1的AgNO3溶液,进行电解。a、b、c、d四个电极上所析出的物质的物质的量之比是( )

A.2∶2∶4∶1 B.1∶1∶2∶1 C.2∶1∶1∶1 D.2∶1∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各溶液中,粒子的物质的量浓度关系正确的是( )
A.0.1 mol·L-1 Na2CO3溶液:[OH-]=[H+]+[HCO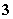 ]+2[H2CO3]
]+2[H2CO3]
B.0.1 mol·L-1 NH4Cl溶液:[NH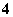 ]=[Cl-]
]=[Cl-]
C.向醋酸钠溶液中加入适量醋酸,得到酸性的混合溶液:
[Na+]>[CH3COO-]>[H+]>[OH-]
D.向硝酸钠溶液中滴加稀盐酸得到pH=5的混合溶液:
[Na+]=[NO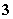 ]+[Cl-]
]+[Cl-]
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,某水溶液M中存在的离子有Na+、A-、H+、OH-。根据题意回答下列问题:
(1)若溶液M由0.1 mol·L-1的HA溶液与0.1 mol·L-1的NaOH溶液等体积混合而得,则溶液M的pH不可能________7(填“大于”、“小于”或“等于”)。
(2)若溶液M的pH>7,则[Na+]________[A-](填“>”、“<”或“=”)。
(3)常温下,若溶液M由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,则下列说法中正确的是________(填字母)。
A.若溶液M呈中性,则溶液M中[H+]+[OH-]=2×10-7 mol·L-1
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2
查看答案和解析>>
科目:高中化学 来源: 题型:
室温时,下列溶液中微粒的浓度关系正确的是 )。
A.0.1 mol·L-1 pH=4的NaHSO3溶液中:cHSO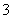 )>cSO
)>cSO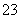 )>cH2SO3)
)>cH2SO3)
B.等体积、等物质的量浓度的NaF溶液与HF溶液混合:cNa+)=cF-)+cHF)
C.在NaHA溶液中一定有:cNa+)+cH+)=cHA-)+cOH-)+cA2-)
D.cNH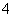 )相等的NH4)2CO3、NH4)2SO4和NH4)2FeSO4)2三份溶液中,溶质的物质的量浓度依次增大
)相等的NH4)2CO3、NH4)2SO4和NH4)2FeSO4)2三份溶液中,溶质的物质的量浓度依次增大
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2CO3水溶液中存在平衡CO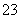 +H2OHCO
+H2OHCO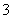 +OH-。下列说法不正确的是
+OH-。下列说法不正确的是
)。
A.稀释溶液,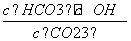 增大
增大
B.通入CO2,溶液pH减小
C.升高温度,平衡常数增大
D.加入NaOH固体,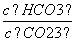 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:
2N2O5(g)4NO2(g)+O2(g) ΔH>0
T1温度下的部分实验数据如表所示:
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是(双选)( )
A.500 s内N2O5的分解速率为2.96×10-3 mol·L-1·s-1
B.T1温度下的平衡常数K1=125,1 000 s时N2O5的转化率为50%
C.其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)的浓度为2.98 mol·L-1,则T1<T2
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1<T3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com