
| A. | 原子半径:C>D>A>B | B. | 离子半径:D>C>A>B | ||
| C. | 原子序数:B>A>D>C | D. | 氢化物稳定性:D>C |
分析 aAn+、bB(n+1)+、cCn-、dD(n+1)-是具有相同电子层结构的短周期元素形成的简单离子,则A、B位于C、D的下一周期,A、B为金属,金属性A>B,C、D为非金属,非金属性C>D,以此来解答.
解答 解:aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),原子序数:b>a>c>d,A、B同周期,C、D同周期,且A、B在周期表中C、D的下一周期,由形成的离子可知,A、B为金属,C、D为非金属性,
A.A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,原子核外电子层数越多,原子半径越大,同周期元素原子序数越大,原子半径越小,则有原子半径:A>B>D>C,故A错误;
B.aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,核电荷数越大离子半径越小,核电荷数b>a>c>d,故离子半径dD(n+1)->cCn->aAn+>bB(n+1),故B正确;
C.aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有原子序数:B>A>C>D,故C错误;
D.C、D在周期表同周期,原子序数c>d,非金属性C>D,对应氢化物的稳定性为C>D,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的位置、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1mol | B. | 0.05mol | C. | 1.05mol | D. | 0.11mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲溶液中c(CH3COO-)一定大于乙溶液中c(CH3COO-) | |
| B. | 甲、乙等体积混合后pH大于2 | |
| C. | 乙溶液离子浓度大小关系为:c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 加入相同浓度的NaOH溶液至中性,甲乙两溶液消耗NaOH溶液的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是直线形结构 | |
| B. | 中心原子都采取 sp1杂化 | |
| C. | 硫原子和碳原子上都没有孤对电子 | |
| D. | SO2 为 V 形结构,CO2为直线形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
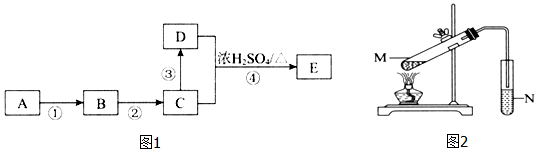
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com