
已知下列反应的热化学方程式:
①6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) ΔH1
②2H2(g)+O2(g)=2H2O(g) ΔH2
③C(s)+O2(g)=CO2(g) ΔH3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为
A.12ΔH3+5ΔH2-2ΔH1 B.2ΔH1-5ΔH2-12ΔH3
C.12ΔH3-5ΔH2-2ΔH1 D.ΔH1-5ΔH2-12ΔH3
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源:2017届广东省高三上第一次阶段考化学试卷(解析版) 题型:选择题
用0.1mol·L-1的NaOH溶液滴定25mL0.1mol·L-1的H2C2O4(草酸)溶液的滴定曲线如图所示。下列说法不正确的是( )

A.草酸是弱酸
B.X点:c(H2C2O4)+c(HC2O4-)=c(Na+)-c(C2O42-)
C.Y点:c(H2C2O4)+c(HC2O4-)=c(OH-)-c(H+)
D.滴定过程中始终存在:c(OH-)+2c(C2O42-)+ c(HC2O4-)= c(Na+)+ c(H+)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省曲靖市高二上第一次月考化学卷(解析版) 题型:填空题
请认真观察下图,然后回答问题:

①图中所示反应是_________(填“吸热”或“放热”)反应,该反应________(填“需要”或“不需要”)加热,该反应的ΔH= kJ/mol(用含E1、E2的代数式表示)。
②已知热化学方程式:H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ/mol。该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为__________kJ/mol。
O2(g)=H2O(g) ΔH=-241.8 kJ/mol。该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为__________kJ/mol。
③对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是:________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A(g) +3B(g)  2C(g)。若维持温度和压强不变,当达到平衡时容器的体积为V,其中C气体的体积占10%。下列推断正确的是
2C(g)。若维持温度和压强不变,当达到平衡时容器的体积为V,其中C气体的体积占10%。下列推断正确的是
A.原混合气体的体积为1.2V B.原混合气体的体积为1.1V
C.反应达平衡时气体B消耗掉0.05V D.反应达到平衡时气体A消耗掉0.05V
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
已知:CO(g)+H2O(g) CO2(g)+H2(g) ∆H=– 41 kJ/mol,相同温度下,在体积均为2L的三个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ∆H=– 41 kJ/mol,相同温度下,在体积均为2L的三个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
n(CO) | n(H2O) | n(CO2) | n(H2) | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q1 |
③ | 1 | 1 | 2 | 1 | 热量变化:Q2 |
下列说法中,不正确的是
A.若容器①中反应10min达到平衡,0至10min时间内,用CO表示的平均反应速率υ(CO)=4.0×10-2 mol/(L·min)
B.容器③中,开始时υ(CO)生成>υ(CO)消耗
C.达平衡过程体系能量的变化:Q1=4Q2
D.平衡时,①与②容器中CO的体积分数相等
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
已知:碳的燃烧热ΔH1=akJ·mol-1;
S(s)+2K(s)=K2S(s)ΔH2=bkJ·mol-1
2K(s)+N2(g)+3O2(g)=2KNO3(s);ΔH3=ckJ·mol-1
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g)ΔH=xkJ·mol-1。则x为
A.3a+b-c B.c+3a-b C.a+b-c D.c+a-b
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
下列说法中正确的说法有几个
①活化分子间的碰撞一定能发生化学反应 ②普通分子间的碰撞有时也能发生化学反应 ③增大反应物浓度,可增大活化分子百分数,从而使有效碰撞次数增多 ④有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 ⑤化学反应的实质是旧化学键断裂和新化学键形成的过程 ⑥催化剂能增大活化分子百分数,从而成千成万倍地增大化学反应速率
A.1个 B.2个 C.3个 D.4个
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上第一次大考化学卷(解析版) 题型:选择题
对于易燃、易爆、有毒的化学物质,往往会在其包装上贴危险警告标签。下面所列物质中,贴错了标签的是( )
| A | B | C | D |
物质的 | NaCl | C2H5OH(酒精) | Hg(汞) | H2SO4(浓) |
危险警 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次月考化学卷(解析版) 题型:填空题
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成 活化分子所需提供的最低限度的能量叫做活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题:
活化分子所需提供的最低限度的能量叫做活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题:
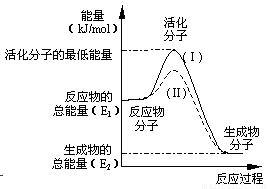
①图中所示反应是__________(填“吸热”或“放热”)反应,该反应____________(填“需要”或“不需要”)加热,该反应的△H=____________(用含E1、E2的代数式表示)。
②已知热化学方程式:H2(g)+1/2O2(g)=H2O(g);△H=-241.8 kJ/mol。该反应的活化能为167.2kJ/mol,则其逆反应的活化能为____________。
③对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率明显加快,你认为最可能的原因是________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com