
| A. | CO2的电子式 | B. | Cl-的结构示意图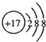 | ||
| C. | MgCl2的电子式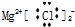 | D. | 质量数为37的氯原子${\;}_{37}^{17}$Cl |
分析 A、CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子;
B、氯离子的最外层有18个电子;
C、相同离子不能合并;
D、氯原子含17个质子.
解答 解:A、CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故A错误;
,故A错误;
B、Cl-的质子数为6,电子数为6,原子结构示意图为: ,故B正确;
,故B正确;
C、MgCl2,氯化镁为离子化合物,化学式中存在阴阳离子,其电子式中需要标出阴阳离子所带电荷,氯化镁的电子式为 ,故C错误;
,故C错误;
D、氯原子含17个质子,且质子数标在左下角,质量数标在左上角,故质量数为37的氯原子为3717Cl,故D错误.
故选B.
点评 本题考查了电子式、结构示意图等的书写,难度不大,应注意的是在书写电子式时,相同离子不能合并.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
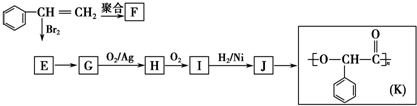
 ;I的结构简式是
;I的结构简式是 .
.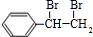 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$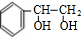 +2NaBr;反应类型属于水解反应.
+2NaBr;反应类型属于水解反应. +H2 $\stackrel{一定条件}{→}$
+H2 $\stackrel{一定条件}{→}$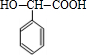 ;反应类型属于加成反应.
;反应类型属于加成反应.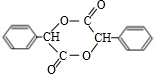 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
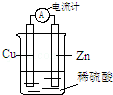
| A. | 将电能转化为化学能 | B. | 一段时间后,铜片质量减轻 | ||
| C. | 电子从锌片经导线流向铜片 | D. | 锌片发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
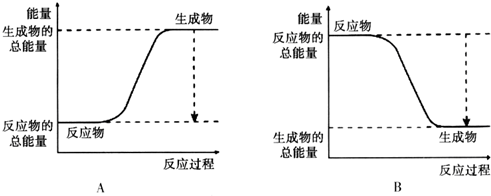
| 化学键 | H-H | O=O | H-O |
| 键能kJ•mol-1 | 436 | 496 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部可以 | B. | ④⑦可以 | C. | ②⑧可以 | D. | ①②③⑥可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com