
| 实验次数 | B与混合气体的体积比 | 反应后气体密度(已换算为标准状况;g/L) |
| 第一次 | 1.0 | 1.35 |
| 第二次 | 1.2 | 1.25 |
| 第三次 | 2.0 | 1.04 |
| 第四次 | 2.2 | -- |
分析 (1)标况下B气体的密度为0.76g/L,则B的相对分子质量=0.76×22.4=17,其中氮的质量分数为82.35%,则B分子中N原子数目=$\frac{17×82.5%}{14}$=1、其余是氢,则H原子数目=$\frac{17-14}{1}$=3,则B为NH3;
(2)假设氨气体积为560L,则水为1L,根据n=$\frac{V}{{V}_{m}}$计算氨气的物质的量,再根据m=nM计算氨气的质量,进而计算溶液质量分数;
根据c=$\frac{1000ρw}{M}$计算溶液物质的量浓度;
(3)在催化剂作用下,NH3可和NO、NO2混合气体反应生成液态水和一种单质气体D,则D为N2,
第一次反应气体的相对分子质量=1.35×22.4=30.24,
第二次反应气体的相对分子质量=1.25×22.4=28,
第三次反应气体的相对分子质量=1.04×22.4=23.2,
由反应后气体相对分子质量可知,第二次实验恰好完全反应,气体为N2,说明第一次剩余氨气不足,第三次剩余氨气有剩余,
令第二次实验中NO、NO2的总物质的量为1mol,则NH3为1.2 mol,设NO为x mol,则NO2为(1-x)mol,根据电子转移守恒列方程计算,进而计算NO的体积分数;
令第四次实验中NO、NO2的总物质的量为1mol,则NH3为2.2 mol,NO为0.2 mol,则NO2为(1-0.2)mol=0.8mol,令参加反应的氨气为y mol,根据电子转移守恒列方程计算,进而计算剩余氨气,根据N原子守恒计算生成N2的物质的量,再根据$\overline{M}$=$\frac{m总}{n总}$计算;
(4)将9.80g NH4Br跟过量的氧化钙共热,充分反应后生成水、1.70g NH3气体和固体产物C,由元素守恒,则C的化学式为CaBr2;
由(1)9.80g NH4Br跟3.60g的某钙盐A恰好反应,生成了4.48L(标准状况)NH3和CaBr2,根据原子守恒计算3.6gA含有各元素原子物质的量,进而确定A的化学式.
解答 解:(1)标况下B气体的密度为0.76g/L,则B的相对分子质量=0.76×22.4=17,其中氮的质量分数为82.35%,则B分子中N原子数目=$\frac{17×82.5%}{14}$=1、其余是氢,则H原子数目=$\frac{17-14}{1}$=3,则B为NH3,
故答案为:NH3;
(2)假设氨气体积为560L,则水为1L,25℃、101.3KPa时,气体摩尔体积为24.5L/mol,氨气的物质的量=$\frac{560L}{24.5L/mol}$=22.86mol,氨气的质量=22.86mol×17g/mol=388.62g,1L水的质量为1000g,则所得溶液质量分数=$\frac{388.62g}{1000g+388.62g}$×100%=27.99%;
所得溶液密度为0.91g/cm3,故溶液物质的量浓度=$\frac{1000×0.91×27.99%}{17}$mol/L=14.98mol/L,
故答案为:27.99;14.98;
(3)在催化剂作用下,NH3可和NO、NO2混合气体反应生成液态水和一种单质气体D,则D为N2,
第一次反应气体的相对分子质量=1.35×22.4=30.24,
第二次反应气体的相对分子质量=1.25×22.4=28,
第三次反应气体的相对分子质量=1.04×22.4=23.2,
由反应后气体相对分子质量可知,第二次实验恰好完全反应,气体为N2,说明第一次剩余氨气不足,第三次剩余氨气有剩余,
令第二次实验中NO、NO2的总物质的量为1mol,则NH3为1.2 mol,设NO为x mol,则NO2为(1-x)mol,根据电子转移守恒:2x+4(1-x)=1.2×[0-(-3)],解得x=0.2,故NO的体积分数为$\frac{0.2mol}{1mol}$×100%=20%;
令第四次实验中NO、NO2的总物质的量为1mol,则NH3为2.2 mol,NO为0.2 mol,则NO2为(1-0.2)mol=0.8mol,令参加反应的氨气为y mol,根据电子转移守恒:2×0.2+4×0.8=y×[0-(-3)],解得y=1.2,剩余氨气为:2.2mol-1.2mol=1mol,根据N原子守恒可知生成N2的物质的量=$\frac{1mol+1.2mol}{2}$=1.1mol,故反应后气体的平均摩尔质量=$\frac{1mol×17g/mol+1.1mol×28g/mol}{1mol+1.1mol}$=22.76g/mol,
故答案为:20;22.76g/mol;
(4)将9.80g NH4Br跟过量的氧化钙共热,充分反应后生成水、1.70g NH3气体和固体产物C,由元素守恒,则C的化学式为CaBr2,
由(1)9.80g NH4Br跟3.60g的某钙盐A恰好反应,生成了4.48L(标准状况)NH3和CaBr2,
NH4Br的物质的量=$\frac{9.8g}{98g/mol}$=0.1mol,由Br元素守恒可知CaBr2为0.05mol,由Ca元素守恒可知,3.6gA中含有Ca原子为0.05mol,氨气的物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,由N元素守恒可知,3.6gA中含有N原子为0.2mol-0.1mol=0.1mol,由H元素守恒,3.6gA中含有H原子为0.2mol×3-0.1mol×4=0.2mol,
故3.6gA中Ca、N、H原子物质的量之比=0.05:0.1:0.2=1:2:4,故A的化学式为CaN2H4,
故答案为:CaN2H4.
点评 本题考查无机物推断、混合物计算、溶液浓度有关计算,题目综合性较大,计算量大,为易错题目,侧重考查学生分析解决问题的能力,难度较大.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶解在过量的稀硝酸中:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | 向NaAlO2溶液中通入少量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 向AlCl3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 用铜除去CuCl2 溶液中少量的FeCl3:Fe2++Cu═Fe3++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
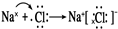
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{(b-a)}{V}$ | B. | $\frac{(2b-a)}{V}$ | C. | $\frac{2(b-a)}{V}$ | D. | $\frac{2(2b-a)}{V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 人体呼出的气体中含有CO2,绿色植物的光合作用吸收CO2,CO2是一种有机化合物 | |
| B. | 水是生命之源,H2O是一种有机化合物 | |
| C. | 绝大多数的含碳物质是有机化合物 | |
| D. | 有机化合物可以转化为无机化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
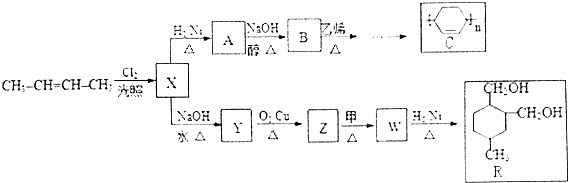
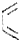 +
+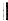 $\stackrel{△}{→}$
$\stackrel{△}{→}$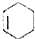
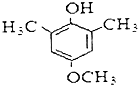 .
.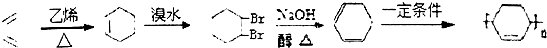 .(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物)
.(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
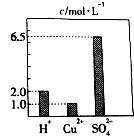 在0.2L由H2SO4、CuSO4和Al2(SO4)3组成的混合溶液中,部分离子浓度大小如图所示,请回答下列问题:
在0.2L由H2SO4、CuSO4和Al2(SO4)3组成的混合溶液中,部分离子浓度大小如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

组号 | 反应温度 (℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/ml | c/mol•L-1 | V/ml | c/mol•L-1 | V/ml | ||
| A | 10 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | a |
| C | 30 | 5 | 0.1 | 10 | 0.1 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 试剂 | 操作方法 |
| A | 二氧化碳 | 一氧化碳 | 氢氧化钠溶液和浓硫酸 | 洗气 |
| B | 硫酸钡 | 碳酸钡 | 足量的稀硫酸 | 溶解、过滤、洗涤、烘干 |
| C | 氯化钙溶液 | 消石灰 | 过量的二氧化碳 | 过滤、蒸发、结晶 |
| D | 氨气 | 水 | 火碱溶液 | 通过盛有火碱溶液的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com