
| A. | 离子的数目相等 | B. | 粒子的总的物质的量相等 | ||
| C. | 正电荷总数和负电荷总数应相等 | D. | 反应前后原子的数目不一定相等 |
分析 根据离子方程式的书写规则的第④步“查”可知:检查式子两边的各种原子的个数及电荷总数一定相等,即一定满足质量守恒和电荷守恒,据此进行判断.
解答 解:根据离子方程式的书写规则,等号两边的各种原子的个数及电荷数必须相等,既遵循原子守恒和电荷守恒,
如:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,表示硫酸和强碱氢氧化钡反应的离子方程式,是正确的,但等号两边离子的数目、微粒的总的物质的量、正电荷和负电荷总数不一定相等,故A、B错误;
离子方程式两边原子数目一定相等,正电荷总数和负电荷总数应相等,即:一定满足电荷守恒和质量守恒,故C正确、D错误;
故选C.
点评 本题考查了离子方程式的书写原则,题目难度不大,明确离子方程式的书写原则为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
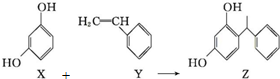
| A. | X、Y和Z均能使溴水褪色 | |
| B. | Y既能发生取代反应,也能发生加成反应 | |
| C. | X和Z均能与NaHCO3溶液反应放出CO2 | |
| D. | Y可作加聚反应单体,X可作缩聚反应单体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
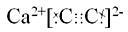
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦⑨ | B. | ②④⑥⑧⑩ | C. | ②⑦⑧⑩ | D. | ②⑤⑧⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 0.1mol•L-1的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| C. | 0.1mol•L-1的氨水中:c(H+)=c(OH-) | |
| D. | 在25℃100mL NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
下列变化中,属于吸热反应的是( )
①液态水的 汽化 ②将胆矾加热变为白色粉末
汽化 ②将胆矾加热变为白色粉末
③浓硫酸稀释 ④KCl03分解制氧气
⑤生石灰跟水反应生成熟石灰
⑥CaCO3高温分解⑦CO2+C 2CO
2CO
⑧Ba(OH)2·8H2O与固体NH4Cl混合
⑨C(s)+H2O(g) CO(g)+H2(g)⑩Al与盐酸反应
CO(g)+H2(g)⑩Al与盐酸反应
A. ②③④⑤⑥⑦⑧⑨ B.②④⑥⑦⑧⑨ C.②④⑥⑧ D.②③④⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
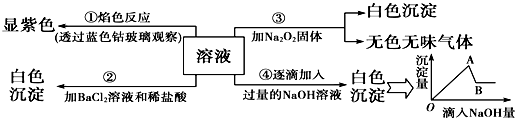
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 海洋是丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用.
海洋是丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用.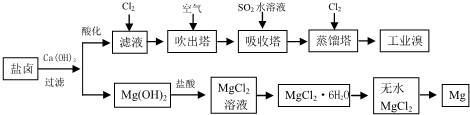
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4与Ba(OH)2溶液反应:Ba2++SO42-═BaSO4↓ | |
| B. | AlCl3溶液中加入过量的浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+═H2O+CO2↑ | |
| D. | 醋酸钠和盐酸混合:CH3COONa+H+═CH3COOH+Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com