
| c2(NH3)平衡 |
| c(N2)平衡c3(H2)平衡 |
| c2(NH3)平衡 |
| c(N2)平衡c3(H2)平衡 |
| △c(H2) |
| c起始(H2) |
| c2(NH3)平衡 |
| c(N2)平衡c3(H2)平衡 |
| △c(H2) |
| c起始(H2) |
| 0.12mol/L |
| 0.3mol/L |
| c2(NH3)平衡 |
| c(N2)平衡c3(H2)平衡 |


科目:高中化学 来源: 题型:
(16分)氨气是一种重要的基础化工原料,用途广泛。
(1)在微电子工业中,氨水可作刻蚀剂H2O2 的清除剂,产物不污染环境。该反应的化学方程式为2NH3 + 3H2O2= +6H2O
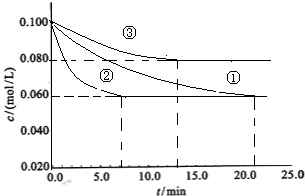
(2)工业中常用以下反应合成氨:N2+3H22NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入N2和H2,浓度均为c(N2) = 0.100mol/L, c(H2)= 0.300mol/L,进行反应时, N2的浓度随时间的变化如图①、②、③曲线所示。
该反应平衡常数的数学表达式为 ;实验②平衡时H2的转化率为_____ 。
(3)据图所示,②、③两装置中各有一个条件与①不同。请指出,并说明判断的理由。
②条件:_______ 理由: ________
③条件:_______ 理由: ________
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)氨气是一种重要的基础化工原料,用途广泛。
在微电子工业中,氨水可作刻蚀剂H2O2 的清除剂,产物不污染环境。该反应的化学方程式为2NH3+3H2O2= +6H2O
工业中常用以下反应合成氨:N2+3H22NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为C(N2)=0.100mol/L,C(H2)=0.300mol/L进行反应时, N2的浓度随时间的变化如下图①、②、③曲线所示。
(1)该反应平衡常数的数学表达式 ;实验②平衡时H2的转化率为_______
(2)据图所示,②、③两装置中各有一个条件与①不同。请指出,并说明判断的理由。
②条件:_______ 理由: ________
③条件:_______ 理由: ________
查看答案和解析>>
科目:高中化学 来源:2010-2011学年广东省高三学年会考(理综)化学部分 题型:填空题
(16分)氨气是一种重要的基础化工原料,用途广泛。
(1)在微电子工业中,氨水可作刻蚀剂H2O2 的清除剂,产物不污染环境。该反应的化学方程式为2NH3 + 3H2O2= +6H2O
(2)工业中常用以下反应合成氨:N2+3H2 2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入N2和H2,浓度均为c(N2) = 0.100mol/L, c(H2)
= 0.300mol/L,进行反应时, N2的浓度随时间的变化如图①、②、③曲线所示。
2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入N2和H2,浓度均为c(N2) = 0.100mol/L, c(H2)
= 0.300mol/L,进行反应时, N2的浓度随时间的变化如图①、②、③曲线所示。

该反应平衡常数的数学表达式为 ;实验②平衡时H2的转化率为_____ 。
(3)据图所示,②、③两装置中各有一个条件与①不同。请指出,并说明判断的理由。
②条件:_______ 理由: ________
③条件:_______ 理由: ________
查看答案和解析>>
科目:高中化学 来源:2010-2011学年广东省中山市高三化学模拟试卷(九) 题型:填空题
(16分)氨气是一种重要的基础化工原料,用途广泛。
在微电子工业中,氨水可作刻蚀剂H2O2 的清除剂,产物不污染环境。该反应的化学方程式为2NH3+3H2O2= +6H2O
工业中常用以下反应合成氨:N2+3H2 2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为C(N2)=0.100mol/L,
C(H2)=0.300mol/L进行反应时, N2的浓度随时间的变化如下图①、②、③曲线所示。
2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为C(N2)=0.100mol/L,
C(H2)=0.300mol/L进行反应时, N2的浓度随时间的变化如下图①、②、③曲线所示。
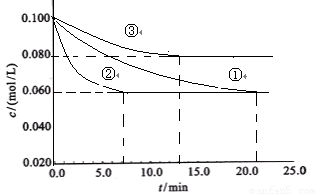
(1)该反应平衡常数的数学表达式 ;实验②平衡时H2的转化率为_______
(2)据图所示,②、③两装置中各有一个条件与①不同。请指出,并说明判断的理由。
②条件:_______ 理由: ________
③条件:_______ 理由: ________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com