
| A. | 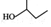 的名称为2-甲基-1-丙醇 的名称为2-甲基-1-丙醇 | B. | 氯乙烯和聚乙烯均能发生加成反应 | ||
| C. | C3H2Cl6 有4种同分异构体 | D. | C2H4和C4H8一定是同系物 |
分析 A.含有羟基的最长碳链为4,在2号碳上含有羟基;
B.聚氯乙烯不含不饱和碳碳键,不能发生加成反应;
C.分子式为C3H2Cl6的有机物可以看作C3Cl8中的两个Cl原子被两个H原子取代,两个H原子可以取代同一碳原子的2个Cl原子,也可以取代不同C原子上的Cl原子,据此书写解答;
D.结构相似最长上相差CH2的有机物互为同系物;
解答 解:A. 含有羟基的最长碳链为4,在2号碳上含有羟基,立强基近的一端编号得到名称为2-丁醇,故A错误;
含有羟基的最长碳链为4,在2号碳上含有羟基,立强基近的一端编号得到名称为2-丁醇,故A错误;
B.氯乙烯能发生加成反应,聚乙烯不能发生加成反应,故B错误;
C.分子式为C3H2Cl6的有机物可以看作C3Cl8中的两个Cl原子被两个H原子取代,
碳链上的3个碳中,两个氢原子取代一个碳上的氯原子,有两种,CCl3-CCl2-CClH2 、CCl3-CH2 -CCl3;
分别取代两个碳上的氯原子,有两种:CCl2H-CCl2-CCl2H(两个边上的),CCl2H-CHCl-CCl3 (一中间一边上),故C3H2Cl6共有四种,故C正确;
D.C2H4和C4H8不一定是同系物,C4H8可以是丁烯也可以是环丁烷,结构不相似,故D错误;
故选C.
点评 本题主要考查的是醇类的命名、同系物、同分异构体等,熟练掌握醇类的命名原则,理解概念实质是解决本题的关键,题目难度中等.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 反应物质 | 反应结果 | 影响因素 |
| A | Zn H2SO4 | H2 SO2 | 锌的还原性 |
| B | Na O2 | Na2O Na2O2 | 反应温度 |
| C | FeCl3溶液Na2S溶液 | 淡黄色或者黑色浑浊 | Na2S溶液加入量 |
| D | AlC13溶液 NaOH溶液 | 澄淸或者浑浊 | 试剂加入顺序 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
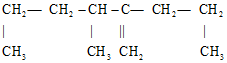 有机物,其正确命名应是( )
有机物,其正确命名应是( )| A. | 2,3-二丙基-1-丁烯 | B. | 2-丙基-3,5-二甲基-1-戊烯 | ||
| C. | 3-甲基-2-丙基-1-己烯 | D. | 3,5-二甲基-2-丙基-1-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S和SO2 | B. | O2 | C. | H2S | D. | SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO2 | B. | CaCO3+H2O+CO2═Ca(HCO3)2 | ||
| C. | CuO+2HCl═CuCl2+H2O | D. | NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入过量的氨气:NH4+、SO42-、Na+、AlO2- | |
| B. | 加入过量NaHCO3溶液:SO42-、Na+、Al3+、HCO3-、Fe2+ | |
| C. | 加入过量氯水:Cl-、SO42-、Fe3+、Al3+ | |
| D. | 加入过量NaNO3溶液:NO3-、SO42-、Fe2+、Al3+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
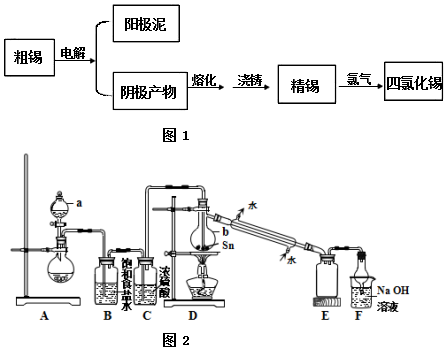
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
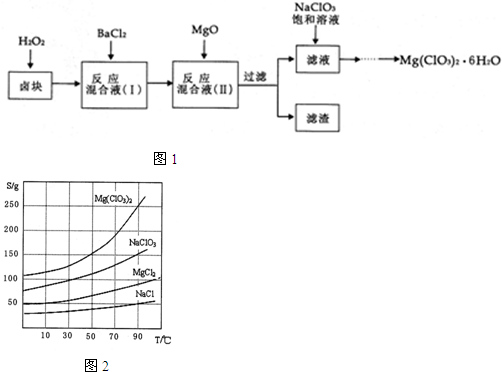
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com