
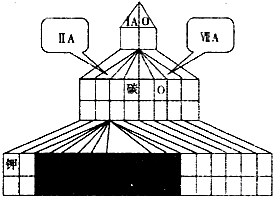
A.由KAt的水溶液制备砹的化学方程式为2KAt+Cl2=2KCl+At2
B.相同条件下HAt比HI稳定
C.AgAt是一种可溶于水的砹化物
D.At在第六周期
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

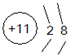
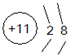


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解



查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由KAt的水溶液制备砹的化学方程式为2KAt+Cl2═2KCl+At2 | B、相同条件下HAt比HI稳定 | C、AgAt是一种难溶于水的化合物 | D、At元素位于第六周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:021
通过分析周期表结构和各元素性质的变化趋势,判断下列关于砹(原子序数为85)及其化合物的叙述中正确的是( )
A.由KAt的水溶液制备砹的化学方程式为2KAt+Cl2=2KCl+At2
B.相同条件下HAt比HI稳定
C.AgAt是一种可溶于水的砹化物
D.At在第六周期
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com