
| A. | 常温常压下,1 L0.1mol•L-1的硝酸铵溶液中氮原子数目为0.2NA | |
| B. | 标准状况下,6.0gNO和2.24LO2混合,所得气体的分子数目为0.2NA | |
| C. | 1 mol有机物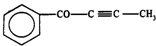 中最多有6 NA个原子在一条直线上 中最多有6 NA个原子在一条直线上 | |
| D. | 1 mol甲基(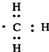 )所含的电子数为7 NA )所含的电子数为7 NA |
分析 A.1mol硝酸铵中含2mol氮原子;
B.NO2中存在平衡:2NO2?N2O4;
C. 中可以有7个原子共直线;
中可以有7个原子共直线;
D.1个甲基中含9个电子.
解答 解:A.1mol硝酸铵中含2mol氮原子,溶液中的硝酸铵的物质的量为n=0.1mol/L×1L=0.1mol,故溶液中含有的氮原子的个数为0.2NA个,故A正确;
B.标准状况下,6.0gNO和2.24LO2混合后生成的NO2中存在平衡:2NO2?N2O4,导致分子个数减小,故B错误;
C.苯环为正六边形结构,夹角均为120°C,所以最多有7个原子共线,故C错误;
D.甲基中含9个电子,故1mol甲基中含9NA个电子,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的判断及计算,掌握物质的量的计算公式和物质结构是解题关键,注意有机物结构特点,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 至少存在5种离子 | |
| B. | SO42-、NH4+、一定存在,Cl-可能不存在 | |
| C. | Cl-一定存在,且c(Cl?)≥0.4mol/L | |
| D. | CO32-、Al3+一定不存在,K+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
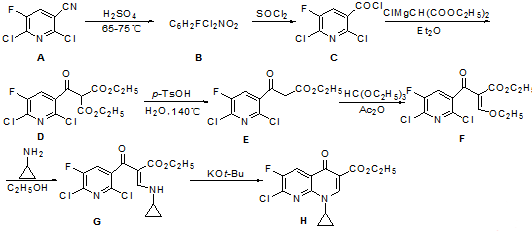
 .由C→D的反应类型是取代反应.
.由C→D的反应类型是取代反应. (其中一种).
(其中一种).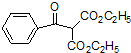 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有 较强的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
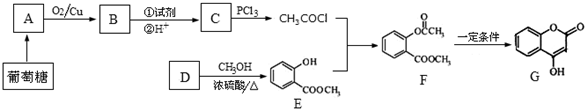
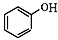 +NaOH→
+NaOH→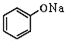 +H2O
+H2O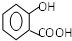 .
. 、CH3COONa、CH3OH.
、CH3COONa、CH3OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
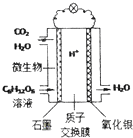 最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图.下列有关该电池的说法正确的是( )
最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图.下列有关该电池的说法正确的是( )| A. | 氧化银电极上反应为:Ag2O+2e-═2Ag+O2- | |
| B. | 石墨电极上反应为:C6H12O6+6H2O+24e-═6CO2↑+24H+ | |
| C. | 每转移4mol电子,氧化银电极产生22.4LCO2气体(标准状况) | |
| D. | 每30g C6H12O6参与反应,有4mo1 H+经质子交换膜进入正极区 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com