
| A. | C20H30O2、C22H30O2 | B. | C22H32O2、C20H30O2 | ||
| C. | C22H30O2、C20H30O2 | D. | C20H30O2、C22H32O2 |
分析 1mol分子式为C67H96O6的某种鱼油完全水解后生成1mol 甘油(C3H8O3)即丙三醇,1mol EPA和2mol DHA,而EPA、DHA均为不饱和羧酸,故C67H96O6为三元酯,据此分析.
解答 解:1mol分子式为C67H96O6的某种鱼油完全水解后生成1mol 甘油(C3H8O3)即丙三醇,1mol EPA和2mol DHA,而EPA、DHA均为不饱和羧酸,故C67H96O6为三元酯,即故方程式可以表示为:C3H8O3+EPA+2DHA$→_{△}^{浓硫酸}$C67H96O6+3H2O,根据原子个数守恒可知,1molEPA和2mol DHA的分子式之和为C64H94O6,故选D.
点评 本题考查了有机物分子式的确定,应注意的是酸和醇在发生酯化反应时,除了生成酯还生成水,且生成的值为几元,则就生成几分子水,难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
| 实验序号 | 自来水的体积 | KI溶液的体积 | 消耗的Na2S2O3溶液的体积 |
| 1 | 10.00mL | 10.00mL | 19.96mL |
| 2 | 10.00mL | 10.00mL | 20.04mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 2 | 4 | 6 | 8 | 10 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
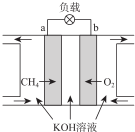
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
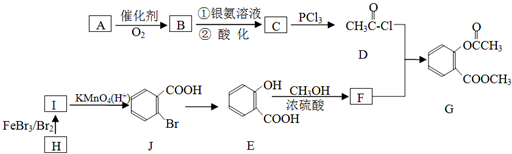
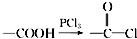 ,请回答以下问题:
,请回答以下问题: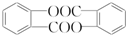 .
.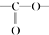 结构
结构 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
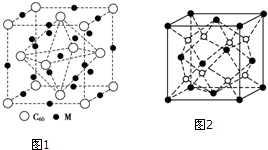
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 25℃时①10-3mol/L的盐酸;②pH=3的NH4Cl溶液;③pH=11的氨水中,水的电离程度为:②>③>① | |
| B. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| C. | pH=8.0的KHS溶液中,c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+) | |
| D. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
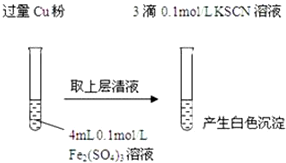
| 实验方案 | 现象 | 结论 |
| 步骤1:取4mL0.1mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
| 步骤2:取取4mL0.1mol/LFeSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
| 实验方案 | 现象 |
| 向3mL 0.1mol/L FeSO4溶液中加入1mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向漂白粉溶液中通入SO2:Ca2++ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| C. | 在碳酸氢钡溶液中加入过量的氢氧化钠溶液:Ba2++2HCO3-+2OH-═BaCO3↓+CO32-+2H2O | |
| D. | 向Na2S2O3溶液中加入稀硫酸:S2O32-+4H+═SO42-+3S↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com