
| | 实验事实 | 结论 |
| A | NH3的水溶液能导电 | NH3是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | Ca(ClO)2溶液中通入CO2产生白色沉淀 | 酸性:H2CO3 >HClO |
| D | Na2SiO3溶液中滴入盐酸,产生白色沉淀 | 非金属性:Cl>Si |
科目:高中化学 来源:不详 题型:实验题
| | 操作 | 预期现象及结论 |
| 方案1 | 取少量黄色溶液,加入NaOH溶液 | 如果生成红褐色沉淀,则说明发生了反应 |
| 方案2 | 取少量黄色溶液,加入淀粉碘化钾溶液 | 如果溶液变蓝色,则说明未发生反应 |
| 方案3 | 取少量黄色溶液,加入四氯化碳,振荡 | 如果下层溶液呈橙红色,则说明: |
| 实验操作 | 预期现象及结论 | 解释现象的离子方程式 |
| | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.检验溴乙烷中的溴元素时,将溴乙烷和氢氧化钠溶液混合加热后,需加硫酸酸化 |
| B.为加快过滤速度,可用玻璃棒搅拌过滤器中的食盐水 |
| C.为迅速除去乙酸乙酯中的少量乙酸,可加入足量NaOH溶液并加热 |
| D.为使制取H2的速率加快,可向稀H2SO4中加少量CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
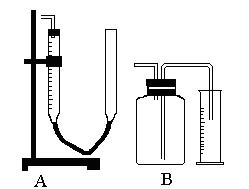
| A.用B量气前,广口瓶中通常应盛满相应的液体 |
| B.用A量气前,测量管中应充满相应的液体 |
| C.收集完气体后,在读数前应使盛液管内(量筒)液面与集气管(瓶)体的容器内液面相平 |
| D.A是直接测量气体体积而B直接测量的是液体的体积 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
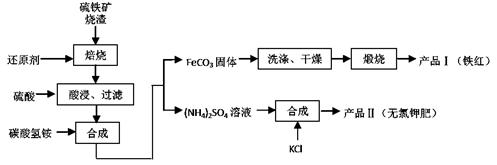
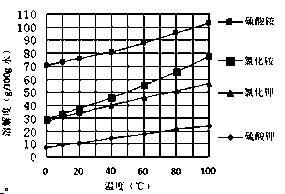
 2SO4溶液中加入KCl溶液后,还需要进行的操作是:。
2SO4溶液中加入KCl溶液后,还需要进行的操作是:。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.实验材料的数量、温度和时间都可能是实验的变量 |
| B.各种实验中都必须设置空白对照组,确保单一变量 |
| C.数据测量应力求精确,因而需要多次测量求平均值 |
| D.探究实验设计中,实验结果总是与提出的假设一致 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
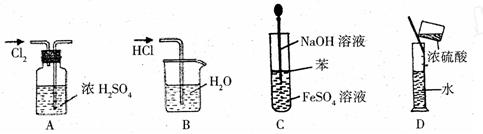
| A.干燥Cl2 | B.吸收HCl |
| C.制取Fe(OH)2沉淀 | D.稀释浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.气体品红溶液褪色 结论:原气体一定是SO2 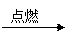 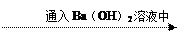 |
| B.气体A气体B白色沉淀 结论:原气体一定是烃  |
| C.某溶液冒白雾白烟 结论:原溶液一定是  浓盐酸 浓盐酸 |
D.某溶液 血红色 血红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com