
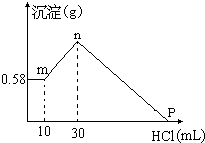
分析 固体组成的混合物溶于足量水后,再加入盐酸时,0-10mL时沉淀的质量不变,说明溶液中NaOH过量,加入10 mL 盐酸恰好中和过量的NaOH,再加盐酸沉淀增多,说明[Al(OH)4]-转化为Al(OH)3,故m点沉淀物为 Mg(OH)2,
10mL~30mL发生反应:[Al(OH)4]-+H+=Al(OH)3↓+H2O,B点溶液中存在的溶质是NaCl,沉淀为Mg(OH)2、Al(OH)3,m点溶液中存在的溶质是氯化钠,
从30mL后发生反应:Al(OH)3+3H+=Al3++3H2O、Mg(OH)2+2H+=Mg2++2H2O,P点溶液为MgCl2、AlCl3和NaCl混合液.
(1)由图可知,氢氧化镁的质量为0.58g,根据镁原子守恒计算n(MgCl2);
(2)生成氢氧化铝沉淀消耗20mL盐酸,根据方程式计算Al(OH)3的物质的量,再根据Al原子守恒计算n(AlCl3);
(3)n点溶液中存在的溶质是氯化钠,根据原子守恒可知n(NaOH)=n(NaCl),则原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl);
(4)P点溶液为MgCl2、AlCl3和NaCl混合液,由氯离子守恒可知,氯化钠中氯离子源于加入盐酸,根据钠离子守恒可知m(NaOH)=n(NaCl),进而计算加入盐酸的体积.
解答 解:固体组成的混合物溶于足量水后,再加入盐酸时,0-10mL时沉淀的质量不变,说明溶液中NaOH过量,加入10 mL 盐酸恰好中和过量的NaOH,再加盐酸沉淀增多,说明[Al(OH)4]-转化为Al(OH)3,故m点沉淀物为 Mg(OH)2,
10mL~30mL发生反应:[Al(OH)4]-+H+=Al(OH)3↓+H2O,B点溶液中存在的溶质是NaCl,沉淀为Mg(OH)2、Al(OH)3,m点溶液中存在的溶质是氯化钠,
从30mL后发生反应:Al(OH)3+3H+=Al3++3H2O、Mg(OH)2+2H+=Mg2++2H2O,P点溶液为MgCl2、AlCl3和NaCl混合液.
(1)由图可知,氢氧化镁的质量为0.58g,其物质的量为$\frac{0.58g}{58g/mol}$=0.01mol,根据镁原子守恒:n(MgCl2)=n[Mg(OH)2]=0.01mol;
故答案为:0.01;
(2)由[Al(OH)4]-+H+=Al(OH)3↓+H2O,则n[Al(OH)3]=n(HCl)=0.5mol/L×(0.03-0.01)L=0.01mol,根据铝原子守恒得n(AlCl3)=n[Al(OH)3]=0.01mol,故AlCl3的质量是0.01mol×133.5g/mol=1.335g,
故答案为:1.335;
(3)n点溶液中存在的溶质是氯化钠,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.01mol×2+0.01mol×3+0.03L×0.5mol/L=0.065mol,故NaOH的质量为0.065mol×40g/mol=2.6g,
故答案为:2.6;
(4)P点溶液为MgCl2、AlCl3和NaCl混合液,由氯离子守恒可知,氯化钠中氯离子源于加入盐酸,根据钠离子守恒可知m(NaOH)=n(NaCl)=0.065mol,C点加入盐酸的体积为$\frac{0.065mol}{0.5mol/L}$=0.13L=130mL,
故答案为:130.
点评 本题考查混合物有关计算,关键是明确每阶段发生的反应,侧重考查学生分析计算能力,注意利用守恒法计算解答,题目难度中等.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:解答题
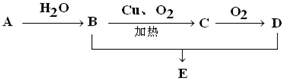 如图所示,已知A的产量是一个国家石油化工水平的标志,D具有酸性.E是具有香味的不溶于水的液体.
如图所示,已知A的产量是一个国家石油化工水平的标志,D具有酸性.E是具有香味的不溶于水的液体.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg的金属性比Al强 | B. | H-的离子半径大于Li+ | ||
| C. | HCl的热稳定性比HF强 | D. | HClO4的酸性比H3PO4强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液中:Fe2+、NO3-、SO42-、I- | |
| B. | 由水电离出的c(OH-)=1×10-13mol•L-1的溶液中:Na+、[Al(OH)4]-、S2-、CO32- | |
| C. | 含有大量Fe3+的溶液中:Na+、I-、K+、NO3- | |
| D. | c(H+)=10-14mol•L-1的溶液中:Mg2+、NO3-、Fe2+、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100ml 18.4mol/L的硫酸溶液中含氢离子的数目为3.68NA | |
| B. | 若x g 中含NA个分子,则2x g中含2NA个分子 | |
| C. | 常温常压下,92gNO2和N2O4的混合气体含有的原子数为6NA | |
| D. | 11g铵根离子[NH2T2]+中含中子数为4.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
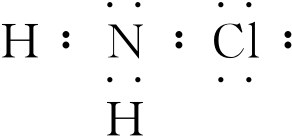 ,H2NCl中氯的化合价为+1价.
,H2NCl中氯的化合价为+1价.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com