
下列有关能量转换的说法正确的是
A.风力发电是化学能转换为电能
B.动物体内的葡萄糖被氧化成CO2,是热能转换成化学能
C.植物通过光合作用将CO2转化为葡萄糖,是将太阳能转换成热能
D.植物燃烧时放出的能量来源于太阳能
科目:高中化学 来源:2015-2016学年河北省高二上学期第一次月考化学试卷(解析版) 题型:选择题
关于原电池和电解池的叙述正确的是
A.原电池失去电子的电极称为阴极
B.电解池的阳极、原电池的负极都发生氧化反应
C.原电池的两极,一定要由活动性不同的两种金属组成
D.电解时电解池的阳极一定是阴离子放电
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上学期第二次诊断性测试化学试卷(解析版) 题型:选择题
下列有关氧化还原反应的叙述中正确的是
A.有单质参加或有单质生成的反应一定是氧化还原反应
B.氧化还原的本质是元素化合价的升降
C.失电子的反应物在反应中作氧化剂,反应中被还原
D.金属单质在化学反应中一定作还原剂
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期第二次月考化学试卷(解析版) 题型:填空题
(8分) T ℃时,在容积为0.5 L的密闭容器中发生如 下反应。mA(g)+nB(g)  pC(g)+qD(s) ΔH<0(m、n、p、q为最简整数比)。A、B、C、D的物质的量变化如图所示。
pC(g)+qD(s) ΔH<0(m、n、p、q为最简整数比)。A、B、C、D的物质的量变化如图所示。
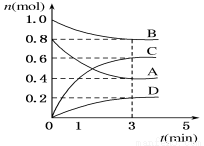
(1)前3 min,v(C)=______________。
(2)在该温度下K=______________
(3)反应达到平衡后,下列措施对A的转化率无影响的是_____________(填选项字母)。
A.保持体积不变,再通入2 mol A和1 mol B
B.移走一部分D
C.把容器的体积缩小一倍
D.升高温度
(4)T ℃时,容积为1 L的密闭容器中,起始时充入0.2 mol A、0.4 mol B、0.3 mol C、0.5 mol D,此时v(正)_____________v(逆)(填“>”“<”或“=”)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二上学期第一次联考化学试卷(解析版) 题型:填空题
(12分)已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当 铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答 下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当 铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答 下列问题。
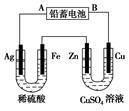
(1)A是铅蓄电池的 极,铅蓄电池正极反应式为 ,放电过程中电解液的密度 (填“减小”、“增大”或“不变”)。
(2)Ag电极的电极反应式是 ,该电极的电极产物共 g。
(3)Cu电极的电极反应式是 ,CuSO4溶液的浓度 (填“减小”、“增大”或“不变”)
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示 。

a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期10月第一次月考化学试卷(解析版) 题型:选择题
下列离子方程式错误的是
A.向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O
B.酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+===2Mn2++5O2↑+8H2O
C.等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-===Mg(OH)2↓
D.铅酸蓄电池充电时的阳极反应:PbSO4+2H2O-2e-===PbO2+4H++SO42-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高一上第一次联考化学试卷(解析版) 题型:选择题
如图是一种验证某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥氯气,C处红色布条颜色无变化;当关闭B,继续通入Cl2时,C处红色布条颜色褪去。则D瓶中盛有的溶液是
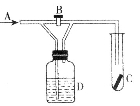
A、浓H2SO4 B、饱和NaCl溶液
C、NaOH溶液 D、Ca (OH) 2悬浊液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西大学附属中学高一上学期第一次月考化学试卷(解析版) 题型:实验题
(10分)用质量分数为36.5%的盐酸(密度为1.16g•cm﹣3)配制1mol•L﹣1的稀盐酸.现实验室仅需要这种盐酸220mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为 mL的容量瓶。
(2)计算已知盐酸的物质的量浓度为 。
(3)经计算需要 mL浓盐酸,在量取时宜选用下列量筒中的 。
A.5mL B.10mL C.25mL D.50mL
(4)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号) 。
(5)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是 (填“偏高”、“偏低”或“无影响”).若用干燥洁净的量筒量取浓盐酸时俯视,则配制的稀盐酸浓度是 (填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省浏阳市高三上学期第二次月考化学试卷(解析版) 题型:选择题
海水是重要的资源,可以制备一系列物质。
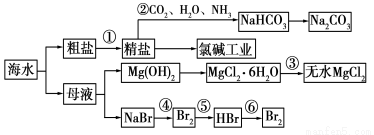
下列说法正确的是
A.步骤②中,应先通CO2,再通NH3
B.步骤③中可将MgCl2·6H2O晶体在空气中直接加热脱水
C.步骤④、⑤、⑥反应中,溴元素均被氧化
D.除去粗盐中SO42-、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com