
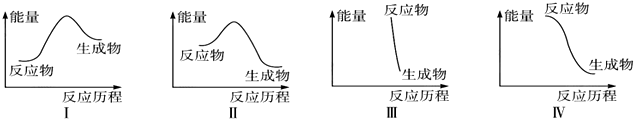
| A. | Ⅰ可表示放热反应 | B. | Ⅱ可表示放热反应 | ||
| C. | Ⅲ可表示爆炸反应 | D. | Ⅳ可表示醋酸和碱的中和反应 |
分析 A.当生成物的能量高于反应物的能量时,反应是吸热反应;
B.当反应物的能量高于生成物的能量时,反应是放热反应;
C.爆炸可以看成是剧烈的燃烧过程,反应物和产物能量差距大;
D.弱酸和碱之间的中和反应是放热反应,生成物的能量较低.
解答 解:A.根据图可以知道:生成物的能量高于反应物的能量,所以反应是吸热反应,故A错误;
B.当反应物的能量高于生成物的能量时,反应是放热反应,故B正确;
C.爆炸是剧烈的燃烧过程,反应物和产物能量差距大,过程表现为放热,故C正确;
D.弱酸和碱之间的中和反应是放热反应,此时生成物的能量低于反应物的能量,故D正确.
故选A.
点评 本题考查学生对放热反应和吸热反应的理解和掌握,难度不大,掌握常见的放热反应和吸热反应是解题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基丙烷和2-甲基丁烷互为同分异构体 | |
| B. | 沸点:正戊烷>正丁烷>2-甲基丙烷 | |
| C. | 分子式分别为C5H12、C9H20和C100H202的有机物一定互为同系物 | |
| D. | 含有5个碳原子的有机物分子中最多可形成4个C-C单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4溶液能使蛋白质变性 | |
| B. | 糖类、油脂和蛋白质都属于高分子化合物 | |
| C. | 油脂有油和脂肪之分,但都属于酯 | |
| D. | 淀粉、油脂和蛋白质都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 信 息 | 问 题 |
| ①短周期元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数均不少于最内层电子数.其中X是形成化合物种类最多的元素. | (1)X元素的最高价氧化物的电子式是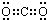 |
| ②在一定条件下,上述四种元素的单质均能与足量的氧气反应,其中Z元素的氧化物既能溶于稀硫酸,又能溶于浓NaOH溶液. | (2)Z元素在元素周期表中位于第 三周期, ⅢA族. |
| ③Y固体单质与盐酸反应,再向反应后的溶液中加入过量的烧碱溶液,最终溶液中有白色沉淀生成. | (3)写出生成白色沉淀的化学方程式 MgCl2+2NaOH═Mg(OH)2↓+2NaCl. |
| ④向上述四种元素的单质的混合物中加入足量的烧碱,固体部分溶解,过滤,向滤液中加入过量 的盐酸溶液,最终溶液中有白色沉淀. | (4)最终生成白色沉淀的离子方程式为 SiO32-+2H+=H2SO3↓. |
| (5)X、Y、Z、W四种元素的原子半径由大到小的顺序为 Mg>Al>Si>C(用元素符号表示) | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑦ | B. | ③④⑦ | C. | ④⑦ | D. | ④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 燃料 | 沸点/℃ | 燃烧热/(kJ•mol-1) | 相对分子质量/(g•mol-1) | 液态密度/(g•cm-3) |
| 氢 | -252.60 | 238.40 | 2.02 | 0.07 |
| 氨 | -33.50 | 317.10 | 17.03 | 0.61 |
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com