
在体积为VL的密闭容器中,充入a molN2和b molH2,经3分钟生成c molNH3.试回答下面问题:
(1)以N2为研究对象,计算其速率v(N2)的值
(2)求H2的转化率
(3)求3分钟时NH3的体积分数
(4)计算反应前后的压强之比.
考点:
化学平衡的计算.
专题:
化学平衡专题.
分析:
(1)先计算出氨气表示的反应速率,然后根据反应方程式N2+3H2⇌2NH3 中化学计量数关系计算出v(N2)的值;
(2)根据氨气的物质的量计算出消耗的氢气的物质的量,再计算出氢气的转化率;
(3)根据差量法计算出反应后混合气体的物质的量,然后计算出氨气物质的量的百分含量含量,相同条件下体积分数就等于物质的量的百分含量;
(4)根据容器容积固定,压强之比就等于物质的量之比计算出反应前后的压强之比.
解答:
解:(1)氨气的反应速率为:v(NH3)=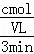 =
=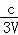 mol/(L•min),根据反应N2+3H2⇌2NH3 ,氮气的反应速率为:v(N2)=
mol/(L•min),根据反应N2+3H2⇌2NH3 ,氮气的反应速率为:v(N2)=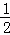 v(NH3)=
v(NH3)=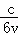 mol/(L•min),
mol/(L•min),
答:速率v(N2)的值为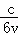 mol/(L•min);
mol/(L•min);
(2)经3分钟生成c molNH3,反应消耗的氢气的物质的量为:n(H2)= n(NH3)=1.5c,氢气的转化率为:
n(NH3)=1.5c,氢气的转化率为: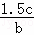 ×100%=
×100%=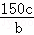 %,
%,
答:H2的转化率为: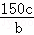 %;
%;
(3)根据反应方程式N2+3H2 ⇌2NH3 △n
1 3 2 2
0.5c 1.5c c c
3分钟时混合气体的物质的量为:a+b﹣c,所以氨气的体积分数为: ×100%=
×100%=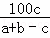 %,
%,
答:3分钟时NH3的体积分数为: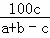 %;
%;
(4)反应后混合气体的物质的量为:a+b﹣c,反应前后的压强之比为: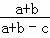 ,
,
答:反应前后的压强之比为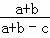 .
.
点评:
本题考查了化学平衡的计算,题目难度中等,注意掌握化学反应速率的计算方法、压强与物质的量的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力及化学计算能力.


科目:高中化学 来源: 题型:
现有①BaCl2 ②金刚石 ③KOH ④H2SO4 ⑤干冰 ⑥碘片 ⑦晶体硅 ⑧金属铜 八种物质,按下列要求回答:(填序号)
(1)熔化时不需要破坏化学键的是 ,熔化时需要破坏共价键的是 ,熔点最高的是 ,熔点最低的是 .
(2)属于离子化合物的是 ,只有离子键的物质是 ,晶体以分子间作用力结合的是 .
(3)请写出③的电子式 ,⑤的电子式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某固体物质只含有钠和氧两种元素,将它放在足量的水中产生两种气体,这两种气体又可以在一定条件下反应生成水,则原固体物质的组成是( )
A.Na2O2与Na2O B.Na和NaOH
C.Na2O2和Na D.Na和Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
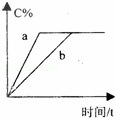
在a、b两个相同的容器中,分别加入相同量的A和B,发生可逆反应:A(g)+3B(g)⇌2C(g)(正反应为放热反应),两容器中C的体积分数与时间的关系如图所示,则a、b两线不同的可能原因是( )
|
| A. | a的温度高于b | B. | a使用了催化剂,而b未用 |
|
| C. | a的压强大于b | D. | a的温度低于b |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实与氢键有关的是( )
|
| A. | HF、HCl、HBr、HI的热稳定性依次减弱 |
|
| B. | 水加热到很高的温度都难以分解 |
|
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
|
| D. | 水结成冰体积膨胀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项比较中前者高于(或大于或强于)后者的是( )
|
| A. | CCl4和SiCl4的熔点 |
|
| B. | 邻羟基苯甲醛( |
|
| C. | SO2和CO2在水中的溶解度 |
|
| D. | H2SO3和H2SO4的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如表:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
| T | 常温常压下,T单质是淡黄色固体,常在火山口附近沉积 |
| P | P的价层电子排布为[Ar]3d104s2 |
(1)W位于元素周期表第 周期第 族;W的原子半径比X的 (填“大”“小”).
(2)TY2中心原子的杂化方式为 ;XY2中一个分子周围有 个紧邻分子;堆积方式与XY2晶胞类型相同的金属有 (从“Cu、Mg、K、Po”中选出正确的),其空间利用率为 .
(3)Z的第一电离能比Mg的 (填“大”或“小”);写出Z单质与NaOH溶液反应的化学方程式 .
(4)写出W的最高价氧化物与NaOH溶液反应的离子方程式 ;W的最高价氧化物与XY2的熔点较高的是,原因是 .
(5)处理含XO、TO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质T.已知:
XO(g)+1/2O2(g)═XO2(g)△H=﹣283.0kJ•mol﹣1
T(s)+O2(g)═TO2(g)△H=﹣296.0kJ•mol﹣1
此反应的热化学方程式是 .
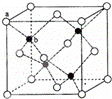
(6)P在周期表的 区;P和T形成的化合物PT在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方PT晶体结构如下图所示,其晶胞边长为540.0pm,密度为 g•cm﹣3(列式并计算).
查看答案和解析>>
科目:高中化学 来源: 题型:
某一反应物的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,在这20s内它的反应速率为( )
|
| A. | 0.04 | B. | 0.04mol/(L•s) | C. | 0.08mol/(L•s) | D. | 0.04mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com