
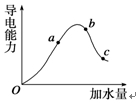
 一定温度下,冰醋酸在加水稀释过程中溶液导电能力的变化曲线如图所示,请回答下列问题:
一定温度下,冰醋酸在加水稀释过程中溶液导电能力的变化曲线如图所示,请回答下列问题:分析 (1)含有自由移动离子或电子的物质能导电;
(2)醋酸是弱电解质,随着醋酸的稀释,醋酸电离程度越大,离子导电能力与离子浓度成正比;
(3)若使c点溶液中的c(CH3COO-)增大,可以采用升高温度、加入含有醋酸根离子的可能性盐、加入固体碱或加入和氢离子反应的固体物质;
(4)加水稀释,促进电离,n(CH3COO-)、n(H+)增大,但浓度减小,以此解答;
(5)A.CH3COOH溶液中存在电荷守恒;
B.向0.10mol/L的CH3COOH溶液中加水,c(H+)减小;
C.CH3COOH溶液中存在水的电离平衡据此分析离子浓度大小;
D.常温下,c(H+)=0.01mol/L的CH3COOH溶液与c(OH-)=0.01mol/L的NaOH溶液等体积混合后,醋酸为弱电解质又电离出氢离子.
解答 解:(1)醋酸是共价化合物,冰醋酸中没有自由移动电子,不能导电,
故答案为:醋酸中无自由移动的离子;
(2)醋酸是弱电解质,随着醋酸的稀释,醋酸电离程度越大,根据图片知,醋酸电离程度最大的是c点,则c点氢离子的物质的量最大,但氢离子浓度最大的是b,
a、b、c三点的pH由小到大的顺序是bac,醋酸溶液中存在电离平衡,CH3COOH?CH3COO-+H+,电离平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$,
故答案为:c;bac;$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$;
(3)A.醋酸是弱电解质,电离时需要吸收热量,所以加热促进醋酸电离,导致醋酸根离子浓度最大,故A正确;
B.加很稀的NaOH溶液,促进醋酸电离,但醋酸电离程度远远小于溶液体积增大程度,所以醋酸根离子浓度减小,故B错误;
C.加KOH固体,KOH和醋酸发生中和反应生成醋酸钾,促进醋酸电离,溶液体积不变,醋酸根离子浓度增大,故C正确;
D.加水促进醋酸电离,但醋酸电离程度远远小于溶液体积增大程度,所以醋酸根离子浓度减小,故D错误;
E.加固体CH3COONa,醋酸钠电离出醋酸根离子导致醋酸根离子浓度增大,故E正确;
F.加入锌粒,锌和氢离子发生置换反应而促进醋酸电离,则醋酸根离子浓度增大,故F正确;
故答案为:ACEF;
(4)加水稀释,酸性减弱,促进电离,n(CH3COO-)、n(H+)增大,但浓度减小,
A、氢离子浓度减小,故A错误;
B、加水稀释,促进电离,n(H+)增大,故B正确;
C、加水稀释促进电离,CH3COOH的分子数减小,故C错误;
D、醋酸的电离平衡常数不变,氢离子浓度减小,醋酸浓度减小,但醋酸分子减小,氢离子增大,所以$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大,故D正确;
故答案为:BD;
(5)A.CH3COOH溶液中存在电荷守恒,各离子浓度的关系为c(H+)=c(OH-)+c(CH3COO-),故A正确;
B.向0.10mol/L的CH3COOH溶液中加水,c(H+)减小,故B错误;
C.CH3COOH溶液中存在水的电离平衡,各离子浓度的关系为c(H+)>c(CH3COO-)>c(OH-),故C错误;
D.常温下,c(H+)=0.01mol/L的CH3COOH溶液与c(OH-)=0.01mol/L的NaOH溶液等体积混合后,醋酸又电离出氢离子,溶液显酸性,故D错误;
故答案为:A.
点评 本题考查了弱电解质电离平衡影响因素、溶液离子浓度大小、电荷守恒等知识点的分析判断,掌握基础是解题关键,题目难度中等.


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. | 由反应①知H2的燃烧热为571.6kJ/mol | |
| B. | 反应②中生成物的总能量高于反应物的总能量 | |
| C. | 反应③若改用新催化剂,△H3不变化 | |
| D. | 反应CH4(g)═C(s)+2H2(g)的△H=+74.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
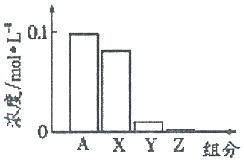 常温下,0.2moI•L-l的Na2CO3溶液与0.2moI•L-l的盐酸等体积混合后,所得溶液中部分微粒组分与浓度的关系如图所示,X、Y、Z均表示含碳微粒,下列说法正确的是( )
常温下,0.2moI•L-l的Na2CO3溶液与0.2moI•L-l的盐酸等体积混合后,所得溶液中部分微粒组分与浓度的关系如图所示,X、Y、Z均表示含碳微粒,下列说法正确的是( )| A. | A代表Na+浓度 | |
| B. | 该溶液中c(OH-)>c(Y) | |
| C. | 向该溶液中加水稀释,所有离子浓度均减小 | |
| D. | 该混合溶液中:c(X)+c(Y)+c(Z)═2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 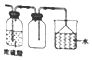 利用图收集干燥的氯化氢气体 | |
| B. | 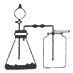 选择合适的试剂,利用图2可分别制取并收集少量CO2、NO和O2 | |
| C. |  利用图可验证铁发生吸氧腐蚀 | |
| D. |  利用图蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 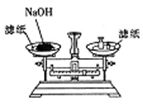 称取一定的NaOH | |
| B. | 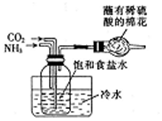 制取Na2CO3 | |
| C. | 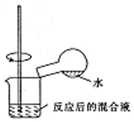 检验浓硫酸与铜反应后的产物中是否含有铜离子 | |
| D. | 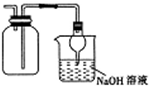 收集NO2并防止其污染环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为保护环境,应减少二氧化硫、氮氧化物和二氧化碳等物质的排放量.
为保护环境,应减少二氧化硫、氮氧化物和二氧化碳等物质的排放量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
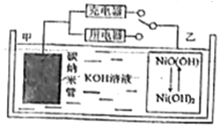 氢燃料电池具有广阔前景.某二次氢燃料电池的原理如图所示,该电池用吸附了H2的碳纳米管等材料制作而成,下列说法正确的是( )
氢燃料电池具有广阔前景.某二次氢燃料电池的原理如图所示,该电池用吸附了H2的碳纳米管等材料制作而成,下列说法正确的是( )| A. | 放电时,甲电极为正极,OH-移向乙电极 | |
| B. | 可开发氢燃料电池用于电动汽车 | |
| C. | 电池总反应为H2+NiO(OH)$?_{充电}^{放电}$Ni(OH)2 | |
| D. | 充电时,乙电极反应式为NiO(OH)+H2O+e-=Ni(OH)2+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
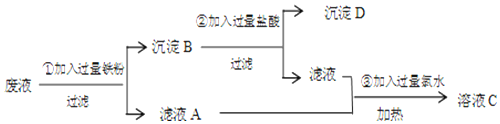
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,其 中q为淡黄色固体;x、y、z是这些元素组成的二元化合物;25℃,0.01mol•L-1w溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是 ( )
短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,其 中q为淡黄色固体;x、y、z是这些元素组成的二元化合物;25℃,0.01mol•L-1w溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是 ( )| A. | 离子半径的大小:a<b<c<d | |
| B. | b氢化物的沸点高于主族其它元素氢化物的沸点 | |
| C. | 将b、c、d组成的化合物加入到水中对水的电离没有影响 | |
| D. | y、w含有的化学键类型完全相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com