
【题目】用下图表示的一些物质或概念间的从属关系中不正确的是

X | Y | Z | |
A | 酸 | 电解质 | 化合物 |
B | 酸式盐 | 盐 | 化合物 |
C | 溶液 | 分散系 | 物质 |
D | 置换反应 | 氧化还原反应 | 离子反应 |
A.AB.BC.CD.D
【答案】D
【解析】
由图可知,概念的范畴为Z包含Y,Y包含X,然后利用物质的组成和性质来分析物质的类别,再根据概念的从属关系来解答。
A.电解质和酸都属于化合物,酸都是电解质,则电解质包含酸,故A正确;
B.盐包括酸式盐,碱式盐,正盐,酸式盐属于盐,盐属于化合物,故B正确;
C.物质分为纯净物和混合物,分散系属于混合物,按照分散质粒子直径大小,可将分散系分为溶液、胶体和浊液,故C正确;
D.置换反应是单质和化合物反应生成另一种单质和另一种化合物的反应,一定有化合价的变化,属于氧化还原反应,氧化还原反应和离子反应是并列关系,是从不同角度对化学反应分类,把是否有化合价变化的反应称为氧化还原反应和非氧化还原反应,把是否有离子参与的反应把化学反应分为离子反应和非离子反应,故D错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表中短周期的一部分,表中所列字母分别代表一种元素。

(1)上述元素的单质中熔点最高的可能是________(填字母);dh4比gh4稳定,其原因是______。
(2)f和a所形成的物质的沸点在f相应主族元素的同类型化合物中比较高,其原因是_____________。
(3)f的氢化物属于___晶体,a与d形成的化合物da4的立体构型是___,它的晶体属于_____晶体。
(4) c、i、j可组成离子化合物cxij6,其晶胞结构如下图所示,阳离子c+(用○表示)位于正方体棱的中点和正方体内部;阴离子ij6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在如图所示的装置里,若灯泡亮,广口瓶内的物质 A 可以是_____(填序号,下同),其中①~⑧中的电解质有_____。
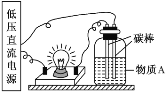
①干燥的氯化钠晶体 ②干燥的氢氧化钠固体 ③蔗糖晶体 ④酒精 ⑤NaHSO4 溶液 ⑥氢氧化钠溶液 ⑦稀盐酸 ⑧Ba(OH)2 溶液
(2)向盛有⑧的溶液中,逐滴加入⑤,当溶液中的Ba2+恰好完全沉淀时,发生反应的离子 方程式为_________。
(3)某无色透明溶液中可能含有下列离子中的一种或几种:Na+、Mg2+、Cu2+、OH-、Cl-、CO32-、NO3-。现进行如下实验:
①用红色石蕊试纸检验,试纸变蓝色。
②另取少量溶液逐滴滴加盐酸至过量,无气体放出,再加入 BaCl2 溶液后,没有沉淀生成。
③另取少量溶液用硝酸酸化后,加入 AgNO3 溶液有白色沉淀生成。 根据上述实验推断:原溶液中肯定有__________离子,肯定没有_____离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,纵轴表示导电能力,横轴表示所加溶液的量,下列说法正确的是( )

A. 曲线A表示NaOH溶液中滴加稀盐酸
B. 曲线B表示CH3COOH溶液中滴加KOH溶液
C. 曲线C表示Ba(OH)2溶液中滴加稀硫酸
D. 曲线D表示Cu(OH)2悬浊液中滴加HNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请写出下列反应的化学方程式或离子方程式:
(1)钠在空气中燃烧:___;
(2)钠与水反应的离子方程式:___;
(3)碳酸钠转化为碳酸氢钠的化学方程式:___;
(4)碳酸氢钠溶液与氢氧化钠溶液反应的离子方程式:___;
(5)氯气和石灰乳反应化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有大量的下列离子:Fe3+、NO3—、K+和M离子,经测定Fe3+、NO3—、K+和M离子的物质的量之比为2:5:1:1,则M离子可能是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:氢化钠(NaH)为白色晶体,其中H-有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,自身被氧化为+1价,写出其化学反应方程式,并用双线桥标出电出电子转移的方向与数目______________________
(2)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用A粉还原NO3-,发生的反应可表示如下,请配平下列反应方程式: ![]() ____、____、____、____、____、___、
____、____、____、____、____、___、
(3)碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:![]()
①该反应的氧化剂是____________氧化产物与还原产物的物质的量比是 __________
②如果反应生成0.3mol的单质碘,则转移的电子数目是_____________
③先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,振荡,静置后观察到的现象是_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液中存在多种平衡,请回答下列问题。
(1)有下列几种溶液:a.NH3·H2O b.CH3COONa c.NH4Cl d.NaHSO4常温下呈酸性的有_________(填序号)。
(2)已知25℃ 时,醋酸的Ka=1.8×10-5 ,碳酸的Ka1=4.3×10-7,Ka2=5.6×10-11。有①NaHCO3溶液,②CH3COONa溶液,③NaOH溶液各25 mL,浓度均为0.1mol/L三种溶液的pH由大到小顺序为______________(请序号);已知NaHCO3溶液呈碱性,该溶液中除水的电离外还存在着两个平衡,用电离方程式或离子方程式表示:_________________、_________________,该溶液中的离子浓度由大到小的顺序是: __________________。
(3)有浓度均为0.1 mol/L的 ①盐酸 ②硫酸 ③醋酸三种溶液,(请用序号填空) 三种溶液的pH由大到小的顺序为____________________;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积大小关系为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是从海藻灰和智利硝石矿层中提取碘的主要反应:①2NaI+MnO2+3H2SO4===2NaHSO4+MnSO4+2H2O+I2 ;②2NaIO3+5NaHSO3===2Na2SO4+3NaHSO4+H2O+I2下列说法正确的是( )
A. 氧化性:MnO2>SO![]() >IO
>IO![]() >I2
>I2
B. I2在反应①中是还原产物,在反应②中是氧化产物
C. 反应①②中生成等量的I2时转移电子数之比为1∶5
D. NaHSO3溶液呈酸性,NaHSO3溶液中c(HSO![]() )>c(H2SO3)>c(SO
)>c(H2SO3)>c(SO![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com