
(12分)用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
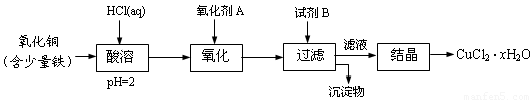
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)氧化剂A可选用_______(填编号,下同)
① Cl2 ② KMnO4 ③ HNO3 ④ H2O2
(2)要得到较纯的产品,试剂B可选用_______
① NaOH ② FeO ③ CuO ④Cu2(OH)2CO3
(3)试剂B的作用是______
① 提高溶液的pH ② 降低溶液的pH ③ 使Fe3+完全沉淀 ④ 使Cu2+完全沉淀
(4)从滤液经过结晶得到氯化铜晶体的方法是_________(按实验先后顺序选填编号)
① 过滤 ② 蒸发浓缩 ③ 蒸发至干 ④ 冷却
(5)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x值,某兴趣小组设计了两种实验方案:
方案一:称取m g晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n g。
方案二:称取m g晶体、加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止、冷却、称量所得固体的质量为n g。
试评价上述两种实验方案,其中正确的方案是______,据此计算得x = _________(用含m、n的代数式表示)。
(12分)(1) ①④(2分)
(2) ③④(2分)
(3) ①③ (2分)
(4) ②④①(2分)
(5)二(2分);
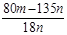 (2分)
(2分)
【解析】
试题分析:(1)四种试剂都具有强氧化性,为的是制取氯化铜晶体,选用的氧化剂反应后不能生成其它杂质离子,因此选用① Cl2 ④ H2O2。(2)试剂B与氧化剂A选择条件是相似的,因此选用③ CuO④Cu2(OH)2CO3。(3)选择的试剂B,通过与酸的反应生成Cu2+且提高溶液的pH。因在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。所以促使了Fe3+完全沉淀。(4)氯化铜晶体的生成,对滤液先加热蒸发使水份减少溶液浓缩,再冷却结晶,过滤就得到了氯化铜晶体。(5)氯化铜晶体灼烧的温度足以分解氯化铜,氯化铜经过灼烧是不能以氯化铜的形式存在的,会分解为CuO,CuCl2+2H2O Cu(OH)2+2HCl Cu(OH)2
Cu(OH)2+2HCl Cu(OH)2 CuO + H20,固体不可能为纯净的CuCl2,因此第一种方法不正确。第二方案中,最终生成的是CuO,根据铜原子守恒可得:
CuO + H20,固体不可能为纯净的CuCl2,因此第一种方法不正确。第二方案中,最终生成的是CuO,根据铜原子守恒可得:
CuCl2?xH2O → CuO
135+18x 80
m n
(135+18x)/m = 80/n
x=(80m-135n)/18n
考点:化学实验 化学计算
点评:解答本题找准考点是关键,考查了盐类水解,注意方案一中最终的固体不可能为纯净的CuCl2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
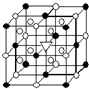 A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子
A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
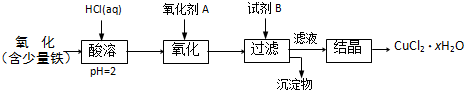
| 80m-135n |
| 18n |
| 80m-135n |
| 18n |
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,Cu2+却不水解。
① 加热酸溶过程中发生反应的化学方程式有: 。
② 氧化剂A可选用 (填编号,下同)。
A.KMnO4 B. HNO3 C. Cl2
③ 要得到较纯的产品,试剂B可选用 。
A. NaOH B. CuO C.FeO
④ 试剂B的作用是 。
A. 使Cu2+完全沉淀 B. 使Fe3+完全沉淀
C. 降低溶液的pH D. 提高溶液的pH
⑤ 从滤液经过结晶得到氯化铜晶体的实验条件是 。
查看答案和解析>>
科目:高中化学 来源:2012届内蒙古呼伦贝尔市牙克石林业一中高三第二次模拟考试化学试卷 题型:填空题
(12分)用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作: 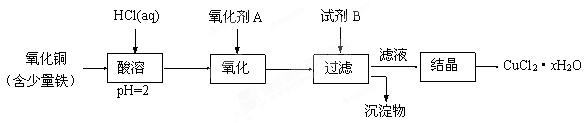
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,Cu2+却不水解。
① 加热酸溶过程中发生反应的化学方程式有: 。
② 氧化剂A可选用 (填编号,下同)。
A.KMnO4 B. HNO3 C. Cl2
③ 要得到较纯的产品,试剂B可选用 。
A. NaOH B. CuO C.FeO
④ 试剂B的作用是 。
A. 使Cu2+完全沉淀 B. 使Fe3+完全沉淀
C. 降低溶液的pH D. 提高溶液的pH
⑤ 从滤液经过结晶得到氯化铜晶体的实验条件是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年高三上学期九月份月考化学试卷(必修1第1-3章部分内容) 题型:选择题
(26分) (1)铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
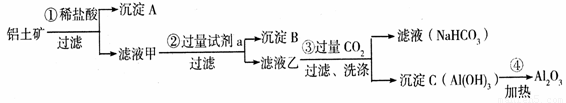
① 沉淀 A、B的成分分别是 、 ;步骤②中的试剂a是 ;
② 试写出步骤③中发生反应的离子方式 、 ;
③简述检验所得滤液甲中存在Fe3+的操作方法:__________ _。
(2)用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
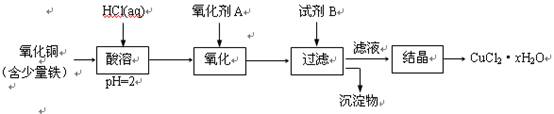
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,Cu2+却不水解。
① 加热酸溶过程中发生反应的化学方程式有: 。
② 氧化剂A可选用 (填编号,下同)。
A.KMnO4 B. HNO3 C. Cl2
③ 要得到较纯的产品,试剂B可选用 。
A. NaOH B. CuO C.FeO
④ 试剂B的作用是 。
A. 使Cu2+完全沉淀 B. 使Fe3+完全沉淀
C. 降低溶液的pH D. 提高溶液的pH
⑤ 从滤液经过结晶得到氯化铜晶体的方法是 (按实验先后顺序选填编号)。
A. 过滤 B. 蒸发至干 C. 冷却 D. 蒸发浓缩
查看答案和解析>>
科目:高中化学 来源:2011-2012学年内蒙古呼伦贝尔市高三第二次模拟考试化学试卷 题型:填空题
(12分)用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
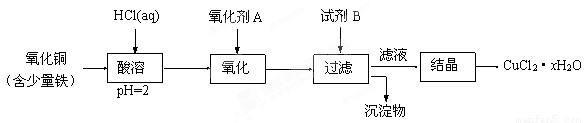
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,Cu2+却不水解。
① 加热酸溶过程中发生反应的化学方程式有: 。
② 氧化剂A可选用 (填编号,下同)。
A.KMnO4 B. HNO3 C. Cl2
③ 要得到较纯的产品,试剂B可选用 。
A. NaOH B. CuO C.FeO
④ 试剂B的作用是 。
A. 使Cu2+完全沉淀 B. 使Fe3+完全沉淀
C. 降低溶液的pH D. 提高溶液的pH
⑤ 从滤液经过结晶得到氯化铜晶体的实验条件是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com