
| A. | NaOH(固体) | B. | H2O | C. | NH4Cl(固体) | D. | CH3COOH |
分析 Fe过量,为了减缓反应速率,且不影响生成氢气的总量,可减小氢离子的浓度,但不能改变氢离子的物质的量,以此来解答
解答 解:Fe与盐酸反应的实质为Fe+2H+═Fe2++H2↑,为了减缓反应速度,且不影响生成氢气的总量,则可减小氢离子的浓度,但不改变氢离子的物质的量.
A、加入NaOH固体,氢离子的物质的量及浓度均减小,故A错误;
B、加入H2O,减小氢离子的浓度,但不改变氢离子的物质的量,故B正确;
C、加入NH4Cl固体,氢离子的浓度、氢离子的物质的量都没有明显变化,故C错误;
D、加入CH3COOH氢离子的物质的量增大,故D错误;
故选B.
点评 本题考查影响反应速率的因素,为高考常考考点,注意Fe过量,生成氢气由盐酸决定,把握浓度对反应速率的影响即可解答,题目难度不大.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(4) | B. | (2)(4) | C. | (4) | D. | (3)(4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
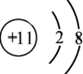
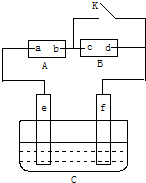 如图,A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图,A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题


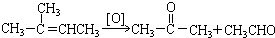
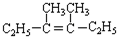 在上述类似条件下发生反应,请写出反应的方程式
在上述类似条件下发生反应,请写出反应的方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
 ;
; ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com