
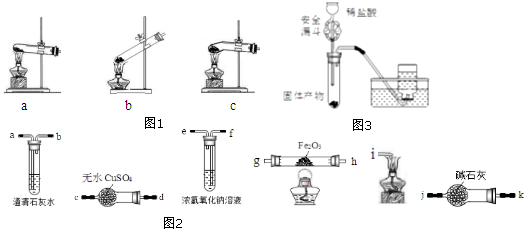
分析 (1)草酸晶体熔点为101℃,加热熔化为液体从导气管中流出,所以不用a装置;b装置中,当170℃以上草酸晶体失去结晶水而成固体,分解生成的水蒸气在试管口冷凝为液体,流回到热的试管底部,使试管炸裂;c装置中试管下端是弯管加热生成的水不会发生倒流;
(2)草酸蒸气进入澄清石灰水也会发生反应生成草酸钙白色沉淀;
(3)用下列装置(图2)检验草酸的分解产物H2O(g)、CO2和CO,先通过干燥管检验生成的水,通过澄清石灰水检验二氧化碳气体的存在,通过氢氧化钠溶液除去气体中的二氧化碳气体,通过碱石灰吸收水蒸气得到干燥的一氧化碳,通过玻璃管中的氧化铁发生反应检验一氧化碳的存在,通过澄清石灰水检验生成的二氧化碳存在,证明含一氧化碳气体,最后剩余一氧化碳气体点燃燃烧处理;
(4)一氧化碳通过玻璃管发生的反应不能使生成的一氧化碳完全反应;
(5)氧化铁发生反应后只有生成的铁和盐酸发生反应生成氢气;安全漏斗的作用是防止生成的气体从漏斗中逸出;
(6)证明草酸是弱酸需要证明水溶液中存在电离平衡,溶液中存在电离平衡,可以测定一定难度的溶液的PH判断;
解答 解:(1)分析装置可知,草酸晶体熔点为101℃,加热熔化为液体从导气管中流出,所以不用a装置;b装置中,当170℃以上草酸晶体失去结晶水而成固体,分解生成的水蒸气在试管口冷凝为液体,流回到热的试管底部,使试管炸裂;c装置中试管下端是弯管加热生成的水不会发生倒流,
故答案为:c;草酸晶体熔点为101℃,加热熔化为液体从导气管中流出,所以不用a;当170℃以上草酸晶体失去结晶水而成固体,分解生成的水蒸气在试管口冷凝为液体,流回到热的试管底部,使试管炸裂,故b不用;
(2)若将产生的气体直接通入澄清石灰水,草酸受热升华,草酸蒸气进入澄清石灰水生成难溶于水的草酸钙沉淀,不能检验分解产物中是否含CO2,
故答案为:不正确,草酸受热升华,草酸蒸气进入澄清石灰水生成难溶于水的草酸钙沉淀;
(3)检验草酸的分解产物H2O(g)、CO2和CO,先通过干燥管检验生成的水,通过澄清石灰水检验二氧化碳气体的存在,通过氢氧化钠溶液除去气体中的二氧化碳气体,通过碱石灰吸收水蒸气得到干燥的一氧化碳,通过玻璃管中的氧化铁发生反应检验一氧化碳的存在,通过澄清石灰水检验生成的二氧化碳存在,证明含一氧化碳气体,最后剩余一氧化碳气体点燃燃烧处理,装置接口连接顺序为:d、ca、bf、ek、jg(或h)、h(或g)a、bi,
故答案为:d、ca、bf、ek、jg(或h)、h(或g)a、bi;
(4)Fe2O3质量的减轻能计算发生反应的CO的量,一氧化碳通过玻璃管发生的反应不能使生成的一氧化碳完全反应,生成的CO没有完全与Fe2O3反应,
故答案为:不能,生成的CO没有完全与Fe2O3反应;
(5)图3装置来证明Fe2O3反应后的固体中含有单质铁,混合物中只有生成的铁和盐酸反应生成氢气,所以可以利用装置进行证明,依据是否有气体生成可以判断反应生成的产物中含有铁,
故答案为:可行,Fe2O3反应后的固体中,只有单质铁才能与稀盐酸反应放出气体;加盐酸时弯管处存有液体,防止产生的气体从漏斗中逸出;
(6)常温下测定已知浓度c(H2CO4)溶液的pH,若溶液pH>-lgc(H2CO4),说明草酸中氢离子不能完全电离,溶液中存在电离平衡,则H2CO4为弱酸或弱电解质存在电离平衡、不完全电离等性质,测定草酸钠溶液的PH,如大于7,则为弱酸,
故答案为:常温下测定已知浓度c(H2CO4)溶液的pH,若溶液pH>-lgc(H2CO4),常温下测定已知浓度c(H2CO4)溶液的pH,若溶液pH>-lgc(H2CO4),则H2CO4为弱酸或弱电解质存在电离平衡、不完全电离等性质,测定草酸钠溶液的PH,如大于7,则为弱酸;
点评 本题考查了物质存在的探究实验方法、物质检验的实验设计、实验基本操作的理解应用,注意装置和试剂的应用判断,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 用二氧化氯(CLO2)、高铁酸钠 Na2FeO4摩尔质量为166g•mol-1等新型
用二氧化氯(CLO2)、高铁酸钠 Na2FeO4摩尔质量为166g•mol-1等新型查看答案和解析>>
科目:高中化学 来源: 题型:选择题
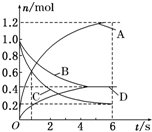 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是( )| A. | 该反应的化学方程式为3B+4D?6A+2C | |
| B. | 反应进行到1s时,v(A)=v(C) | |
| C. | 反应进行到6s时,B和D的物质的量浓度均为0.4mol•L-1 | |
| D. | 反应进行到6s时,B的平均反应速率为0.05mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某铜(Ⅱ)盐晶体组成可以表示为Ka[Cub(C2O4)c]•dH2O,其组成可通过下列实验测定:
某铜(Ⅱ)盐晶体组成可以表示为Ka[Cub(C2O4)c]•dH2O,其组成可通过下列实验测定:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂存在条件下苯与溴反应制溴苯 | |
| B. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯 | |
| C. | 一定条件下,乙烯与氯化氢反应制氯乙烷 | |
| D. | 光照条件下,乙烷与氯气反应制氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com