
| ĪļÖŹ | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| ÄÜĮæ£ØkJ£© | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
·ÖĪö £Ø1£©ĘĘ»µ1mol ĪļÖŹÖŠµÄ»Æѧ¼üĖłĻūŗĵÄÄÜĮæŌ½øßŌņĖµĆ÷ĪļÖŹŌ½ĪČ¶Ø£¬ĪļÖŹ¾ßÓŠµÄÄÜĮæŌ½µĶ£»
£Ø2£©ĘĘ»µ1mol ĪļÖŹÖŠµÄ»Æѧ¼üĖłĻūŗĵÄÄÜĮæŌ½øßŌņĖµĆ÷ĪļÖŹŌ½ĪČ¶Ø£»
£Ø3£©øł¾ŻŠĀ¼üÉś³É·ÅČČĒéæöŗĶ¾É¼ü¶ĻĮŃĪüČČĒéæöĄ“¼ĘĖć»Ų“š£®
½ā“š ½ā£ŗ£Ø1£©øł¾Ż±ķÖŠŹż¾ŻæÉÖŖ£¬ĘĘ»µ1molĒāĘųÖŠµÄ»Æѧ¼üĖłĻūŗĵÄÄÜĮæ×īøߣ¬ŌņĖµĆ÷ĒāĘų×īĪČ¶Ø£¬¾ßÓŠµÄÄÜĮæ×īµĶ£¬
¹ŹŃ”£ŗA£»
£Ø2£©øł¾Ż±ķÖŠŹż¾ŻæÉÖŖ£¬ĘĘ»µ1molĀČ»ÆĒāÖŠµÄ»Æѧ¼üĖłĻūŗĵÄÄÜĮæ×īøߣ¬ŌņĖµĆ÷HCl×īĪČ¶Ø£¬
¹ŹŃ”£ŗA£»
£Ø3£©øł¾Ż·“Ó¦Cl2+H2ØT2HCl£¬æÉŅŌ¼ĘĖć·“Ó¦µÄ”÷H=·“Ó¦ĪļµÄ¼üÄÜŗĶ-Éś³ÉĪļµÄ¼üÄÜŗĶ=243KJ/mol+436KJ/mol-2”Į431KJ/mol=-183kJ/mol£¬ŠĀ¼üÉś³ÉŹĶ·ÅµÄČČĮæ“óÓŚ¾É¼ü¶ĻĮŃĪüŹÕµÄČČĮ棬ĖłŅŌ1molCl2Óė×ćĮæµÄH2ĶźČ«·“Ó¦Ź±·Å³öČČĮæ183kJ£¬
¹ŹŃ”£ŗB£®
µćĘĄ ±¾Ģāæ¼²éѧɜӊ¹Ų»Æѧ¼üŗĶ·“Ó¦ČČÖ®¼äµÄ¹ŲĻµÖŖŹ¶£¬æÉŅŌøł¾ŻĖłŃ§ÖŖŹ¶½ųŠŠ»Ų“š£¬×¢ŅāŠĀ¼üÉś³É·ÅČČĒéæöŗĶ¾É¼ü¶ĻĮŃĪüČČ£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | “æĮņĖįµÄĦ¶ūÖŹĮæĪŖ98 | |
| B£® | ÉĻŹö100mLĻ”ĮņĖįÖŠŗ¬ČÜÖŹ14g | |
| C£® | ÉĻŹöĻ”ŹĶ¹ż³ĢĖłŠčŅŖµÄÕōĮóĖ®ĪŖ90mL | |
| D£® | ÖŹĮæ·ÖŹżĪŖ50%µÄĮņĖįĪļÖŹµÄĮæÅضČĪŖ7.14mol/L |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
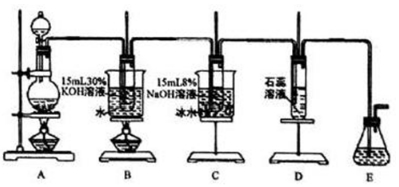
 ÓŠŅ»ĶøĆ÷ČÜŅŗ£¬æÉÄÜŗ¬ÓŠ½Ļ“óĮæµÄMg2+”¢Fe3+”¢Al3+”¢Cu2+”¢Na+”¢SO42-”¢OH-ÖŠµÄŅ»ÖÖ»ņ¼øÖÖĄė×Ó£¬Č”“ĖČÜŅŗ×öĻĀĮŠŹµŃ飮
ÓŠŅ»ĶøĆ÷ČÜŅŗ£¬æÉÄÜŗ¬ÓŠ½Ļ“óĮæµÄMg2+”¢Fe3+”¢Al3+”¢Cu2+”¢Na+”¢SO42-”¢OH-ÖŠµÄŅ»ÖÖ»ņ¼øÖÖĄė×Ó£¬Č”“ĖČÜŅŗ×öĻĀĮŠŹµŃ飮²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ŃŠ¾æ·¢ĻÖ£¬NOxŗĶSO2ŹĒĪķö²µÄÖ÷ŅŖ³É·Ö£¬ŅŃÖŖ£ŗ
ŃŠ¾æ·¢ĻÖ£¬NOxŗĶSO2ŹĒĪķö²µÄÖ÷ŅŖ³É·Ö£¬ŅŃÖŖ£ŗ| »ÆѧŹ½ | H2CO3 | H2SO3 |
| µēĄėĘ½ŗā³£Źż | K1=4.30”Į10-7 K2=5.61”Į10-11 | K1=1.54”Į10-2 K2=1.02”Į10-7 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
| ŹµŃé²½Öč | Ō¤ĘŚĻÖĻóŗĶ½įĀŪ |
| ²½Öč1£ŗȔɣĮæĪüŹÕŅŗÓŚŹŌ¹ÜÖŠ£¬µĪ¼Ó3mol•L-1 H2SO4ÖĮČÜŅŗ³ŹĖįŠŌ£¬Č»ŗó½«ĖłµĆČÜŅŗ·ÖÖĆÓŚA”¢BŹŌ¹ÜÖŠ | ------------- |
| ²½Öč2£ŗ ĻņAŹŌ¹ÜÖŠ¼ÓČė1-2mL 0.0lmol•L-1 KMnO4ČÜŅŗ£¬Õńµ“ŹŌ¹Ü | £Ø1£©ČōČÜŅŗĶŹÉ«£¬Ōņ¼ŁÉč1³ÉĮ¢ £Ø2£©ČōČÜŅŗ²»ĶŹÉ«£¬Ōņ¼ŁÉč2»ņ3³ÉĮ¢ |
| ²½Öč3£ŗ ĻņBŹŌ¹ÜÖŠµĪ¼Ó1-2µĪµķ·Ū-KIČÜŅŗ | £Ø1£©ČōČÜŅŗ±äĄ¶£¬Ōņ¼ŁÉč³ÉĮ¢ £Ø2£©ČōČÜŅŗ²»±äĄ¶£¬×ŪŗĻ²½ÖčÖŠµÄ£Ø2£©£¬Ōņ¼ŁÉč2³ÉĮ¢ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
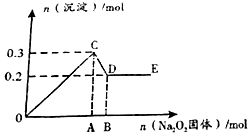
 ĻÖÓŠŅ×ČÜĒæµē½āÖŹµÄ»ģŗĻČÜŅŗ10L£¬¹²ÖŠæÉÄÜŗ¬K+”¢Ba2+”¢Na+”¢NH4+”¢Cl-”¢SO42-”¢AlO2-”¢OH-ÖŠµÄ¼øÖÖ£¬ĻņĘäÖŠĶØČėCO2ĘųĢ壬²śÉś³ĮµķµÄĮæÓėÓöČėCO2µÄĮæÖ®ĪŹµÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
ĻÖÓŠŅ×ČÜĒæµē½āÖŹµÄ»ģŗĻČÜŅŗ10L£¬¹²ÖŠæÉÄÜŗ¬K+”¢Ba2+”¢Na+”¢NH4+”¢Cl-”¢SO42-”¢AlO2-”¢OH-ÖŠµÄ¼øÖÖ£¬ĻņĘäÖŠĶØČėCO2ĘųĢ壬²śÉś³ĮµķµÄĮæÓėÓöČėCO2µÄĮæÖ®ĪŹµÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A£® | øĆČÜŅŗÖŠÄÜČ·¶Ø“ęŌŚµÄĄė×ÓŹĒBa2+”¢Na+”¢Cl-”¢NH4+ | |
| B£® | æĻ¶Ø²»“ęŌŚµÄĄė×ÓŹĒCl-”¢OH- | |
| C£® | Čō²»ÄÜČ·¶ØµÄĄė×ÓÖŠÖĮÉŁ»¹“ęŌŚŅ»ÖÖŃōĄė×Ó£¬ŌņøĆĄė×ÓµÄ×īŠ”ÅضČĪŖ£ŗ0.2mol/L | |
| D£® | OA¶Ī·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ£ŗ2AlO2-+CO2+3H2OØT2Al£ØOH£©3”ż+CO32- |
²éæ““š°øŗĶ½āĪö>>
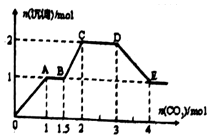
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
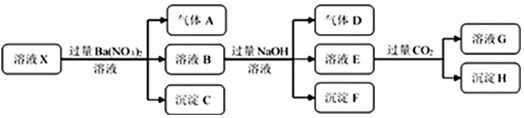
| A£® | ČōŅŖČ·¶ØČÜŅŗXÖŠŹĒ·ńŗ¬ÓŠFe3+£¬Ęä²Ł×÷ĪŖȔɣĮæŌČÜŅŗÓŚŹŌ¹ÜÖŠ£¬¼ÓČėŹŹĮæKSCNČÜŅŗ£¬ČÜŅŗ±äŃŖŗģÉ«£¬Ōņŗ¬ÓŠFe3+ | |
| B£® | ³ĮµķCĪŖBaSO4£¬³ĮµķHĪŖBaCO3 | |
| C£® | ČÜŅŗÖŠŅ»¶Øŗ¬ÓŠH+”¢Al3+”¢NH4+”¢Fe2+”¢SO42-”¢Cl- | |
| D£® | ČōČÜŅŗXĪŖ100mL£¬²śÉśµÄĘųĢåAĪŖ112mL£Ø±źæö£©£¬ŌņXÖŠc£ØFe2+£©=0.05mol•L-1 |
²éæ““š°øŗĶ½āĪö>>
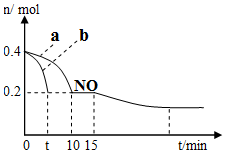
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
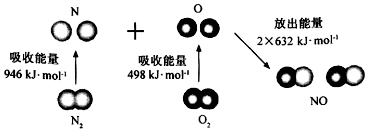
| A£® | Ö±¹Ūæ“£¬øĆ·“Ó¦ÖŠ·“Ó¦ĪļĖł¾ßÓŠµÄ×ÜÄÜĮæµĶÓŚÉś³ÉĪļĖł¾ßÓŠµÄ×ÜÄÜĮæ | |
| B£® | 2 molĘųĢ¬ŃõŌ×Ó½įŗĻÉś³ÉO2£Øg£©Ź±£¬Äܷųö498 KJÄÜĮæ | |
| C£® | ¶ĻĮŃ1 mol NO·Ö×ÓÖŠµÄ»Æѧ¼ü£¬ŠčŅŖĪüŹÕ632KJÄÜĮæ | |
| D£® | øĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗN2+O2ØT2NO”÷H=+180KJ/mol£® |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ×å ÖÜĘŚ | ¢ńA | ¢ņA | ¢óA | ¢ōA | ¢õA | ¢öA | ¢÷A | 0 |
| 2 | ¢Ł | ¢Ś | ||||||
| 3 | ¢į | ¢Ū | ¢Ü | ¢Ż | ¢Ž | ¢ß | ¢ą |
 £»
£»²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com