
| A. | a-3-b | B. | b-3-a | C. | a+3-b | D. | a-3+b |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
 (1)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g)△H=-190kJ/mol
(1)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g)△H=-190kJ/mol| T/°C | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl CO2 Ne | B. | O2 KF SO2 | ||
| C. | HCl CH3CH2OH CH4 | D. | Na202 N2 H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
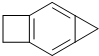 有机化合物的结构简式可进一步简化,如:
有机化合物的结构简式可进一步简化,如: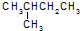 可简化为
可简化为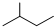 ,如图是一种形状酷似发射航天器的火箭的有机物分子(Rocketene),有关Rocketene的说法正确的是( )
,如图是一种形状酷似发射航天器的火箭的有机物分子(Rocketene),有关Rocketene的说法正确的是( )| A. | 该有机物属于烃的衍生物 | |
| B. | 该有机物属于苯的同系物 | |
| C. | Rocketene分子式为C9H8 | |
| D. | Rocketene与液溴用铁作催化剂反应生成的一溴代物有四种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
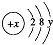
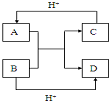
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
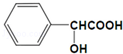
 +2Na→
+2Na→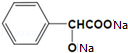 +H2↑.
+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同时增大 | B. | 同时减小 | C. | 增大,减小 | D. | 减小,增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入无水CuSO4再过滤 | B. | 加入生石灰再蒸馏 | ||
| C. | 加入浓硫酸再加热,蒸出乙醇 | D. | 将酒精直接加热蒸馏出乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com