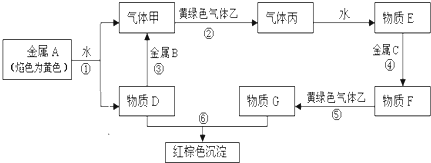
分析:金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H
2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl
2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀是Fe(OH)
3,故物质G中含有Fe
3+,由转化关系HCl
物质F
物质G,可知金属C为Fe,物质F为FeCl
2,物质G为FeCl
3,结合物质的性质解答该题.
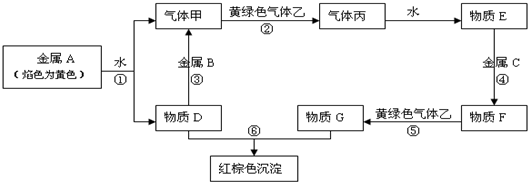
解答:解:金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H
2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl
2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀是Fe(OH)
3,故物质G中含有Fe
3+,由转化关系HCl
物质F
物质G,可知金属C为Fe,物质F为FeCl
2,物质G为FeCl
3,
(1)由以上分析可知,B为Al,C为Fe,乙为Cl
2,故答案为:Al;Fe;Cl
2;
(2)Na在空气中燃烧生成过氧化钠,是淡黄色的粉末,过氧化钠与与CO
2反应放出的气体是氧气,该反应可应用于呼吸面具或潜水艇供氧,
故答案为:淡黄色;氧气;呼吸面具或潜水艇供氧;
(3)反应①为钠和水的反应,生成氢氧化钠和氢气,反应离子方程式为:2Na+2H
2O═2Na
++2OH
-+H
2↑,
反应③是铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH
-+2H
2O═2AlO
2-+3H
2↑,
故答案为:2Na+2H
2O═2Na
++2OH
-+H
2↑;2Al+2OH
-+2H
2O═2AlO
2-+3H
2↑;
(4)FeCl
2加入NaOH溶液,发生反应的化学方程式为:FeCl
2+2NaOH=Fe(OH)
2↓+2NaCl、4Fe(OH)
2+2H
2O+O
2=4Fe(OH)
3,看到的现象为:生成白色沉淀,迅速变成灰绿色,最终变为红褐色,
故答案为:生成白色沉淀,迅速变成灰绿色,最终变为红褐色;FeCl
2+2NaOH=Fe(OH)
2↓+2NaCl;4Fe(OH)
2+2H
2O+O
2=4Fe(OH)
3;
(5)HCl极易与空气中的水蒸气结合,空气中遇水蒸气产生白雾现象,它的水溶液叫盐酸,检验其阴离子所用试剂是:稀硝酸和硝酸银溶液,
故答案为:白雾;盐酸;稀硝酸和硝酸银溶液.



 阅读快车系列答案
阅读快车系列答案