
【题目】“保护环境”我国的基本国策.下列做法不应该提倡的是( )
A.发展公共交通绿色出行
B.过度开发资源促进经济发展
C.煤炭燃烧时安装“固硫”装置
D.对生活废弃物进行分类处置
科目:高中化学 来源: 题型:
【题目】(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是________________________
(2)如图是某温度下,N2与H2反应过程中能量变化的曲线图。
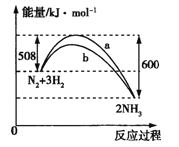
a、b两条曲线产生区别的原因很可能是________________。
(3)在101 kPa时,H2在1.00 mol O2中完全燃烧生成2.00 mol H2O(l)时放出571.6 kJ热量,则H2的热值为________
(4)已知:Fe2O3(s)+3C(石墨)===2Fe(s)+3CO(g) ΔH=489.0 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
C(石墨)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
由Fe(s)和O2(g)反应生成Fe2O3(s)的热化学方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是

A. 装置甲中X电极附近有气泡产生
B. 装置乙中Y电极上的反应式为Cu2++2e-=Cu
C. 装置丙中溶液的pH增大
D. 四种金属的活动性强弱顺序为W>X>Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃、101kPa时,一些物质的燃烧热为:
化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
ΔH/(kJ/mol) | -283.0 | -285.8 | -726.51 | -890. 31 |
请回答下列问题:
(1)根据盖斯定律完成下列反应的热化学方程式:
CO(g)+2H2(g)==CH3OH(l) ΔH=_________。
(2)现有H2和CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3 242.5 kJ,则原混合气体中H2和CH4的物质的量之比是:____________。
A.1:1 B.1:3 C.1:4 D.2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是 ( )
A. c(OH—)/c(NH3·H2O) B. c(NH3·H2O)/ c(OH—)
C. C. c(OH—)· c(H+ ) D. n(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,密闭容器中发生反应 a X (g)![]() b Y (g) + c Z (g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
b Y (g) + c Z (g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
A. 可逆反应的化学计量数:a>b+c B. 压缩容器的容积时,υ正增大,υ逆减小
C. 达到新平衡时,物质X的转化率减小 D. 达到新平衡时,混合物中Z的质量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯为原料合成F,转化关系如下: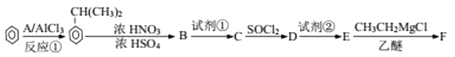
F是一种具有重要工业价值的芳香化合物,含有C、H、O、N 四种元素,其蒸气密度是相同状况下氢气密度的74.5倍,分子中有两个互为对位的取代基。C能与碳酸氢钠反应,试剂②为Fe/HCl。已知:
①![]()
②![]() 苯胺:弱碱性,易氧化
苯胺:弱碱性,易氧化
③![]()
请回答下列问题:
(1)反应① 为加成反应,写出A的化学式_________。
(2)B中所含官能团的名称为_______;生成B时,常伴有附反应发生,反应所得产物除B外可能还含有____________(写出一种的结构简式)。
(3)试剂①是指_________;试剂①和试剂②的顺序能否互换________;为什么?________。
(4)E生成F的化学方程式___________________。
(5)参照上述合成路线,以(CH3)2CHCHO为原料(无机试剂任选),设计制备(CH3)2CHCOCH3的合成路线。________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,气体被还原的是( )
A.二氧化碳使Na2O2固体变白
B.氯气使KBr溶液变黄
C.乙烯使Br2的四氯化碳溶液褪色
D.氨气使AlCl3溶液产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】放热反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
A.若增大CO的浓度,K2 和K1都增大 B.K2 >K1
C.c2(CO)=c2(H2O) D. c1(CO)>c2(CO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com