
【题目】铁及其化合物在生产、生活中有广泛的应用。
(1)复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解制氢气,原理如下:
①MnFe2O4(s)===MnFe2O(4-x)(s)+x/2O2(g) ΔH1
②MnFe2O(4-x)(s)+xH2O(g)===MnFe2O4(s)+xH2(g) ΔH2
③2H2O(g)===2H2(g)+O2(g) ΔH3
则:ΔH3与ΔH1、ΔH2的关系为ΔH3=________。
(2)纳米铁是重要的储氢材料,可用下列反应制得:Fe(s)+5COFe(CO)5(g) ΔH<0。在1 L恒容密闭容器中加入足量铁粉和0.5 mol CO,在T1、T2不同温度下进行反应,测得c(CO)与温度、时间的关系如图1所示。

①T1________(填“>”或“<”)T2。
②T2温度下,上述反应的平衡常数K=________(结果不要求带单位)。
(3)高铁酸钾(K2FeO4)被人们称为“绿色化学”净水剂。高铁酸钾在酸性至弱碱性条件下不稳定。
①工业上用KClO与Fe(NO3)3溶液反应制得K2FeO4,反应的离子方程式为____________________。制备K2FeO4时,KClO饱和溶液与Fe(NO3)3饱和溶液混合的操作为________________________。
②已知K2FeO4在水解过程中铁元素形成的微粒分布分数与pH的关系如图所示。


向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为____________________________________。
(4)电解法可制得K2FeO4,装置如图所示。阳极的电极反应式为________。
【答案】2(ΔH1+ΔH2)/x > 8×103 3ClO-+2Fe3++10OH-===2FeO42-+3Cl-+5H2O 在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中 HFeO4-+OH-===FeO42-+H2O Fe-6e-+8OH-===FeO42-+4H2O
【解析】
(1)根据盖斯定律结合热化学方程式计算可得ΔH3与ΔH1、ΔH2的关系;
(2) ①该反应的正反应为放热反应,升高温度平衡向逆反应方向移动,CO的浓度增大,以此判断;
②根据图中数据,列出三段式,找出平衡浓度,根据K=![]() 计算;
计算;
(3)①ClO-与Fe3+反应生成FeO42-,ClO-被还原为Cl-,根据得失电子守恒和电荷守恒及原子守恒写出反应的离子方程式;
制备K2FeO4时,K2FeO4在Fe3+和Fe(OH)3催化作用下发生分解,应把Fe(NO3)3饱和溶液滴加到KClO溶液中;
②由图可知,pH=6时溶液主要存在HFeO4-,加入KOH溶液发生中和,以此写出该反应的离子方程式;
(4)铁是阳极失去6个电子生成FeO42-,据此书写阳极反应式。
(1) 已知:①MnFe2O4(s)===MnFe2O(4-x)(s)+x/2O2(g) ΔH1
②MnFe2O(4-x)(s)+xH2O(g)===MnFe2O4(s)+xH2(g) ΔH2
③2H2O(g)===2H2(g)+O2(g) ΔH3
由热化学方程式结合盖斯定律,将反应①![]() 2+②
2+②![]() 2可得2xH2O(g)===2xH2(g)+xO2(g) ΔH=
2可得2xH2O(g)===2xH2(g)+xO2(g) ΔH=
2(ΔH1+ΔH2),反应③![]() x可以得到相同的热化学方程式,则有ΔH3=2(ΔH1+ΔH2)/x。
x可以得到相同的热化学方程式,则有ΔH3=2(ΔH1+ΔH2)/x。
故答案为:2(ΔH1+ΔH2)/x;
(2) ①该反应的正反应为放热反应,升高温度平衡向逆反应方向移动,平衡时CO的浓度增大,由图可知,T2时CO平衡浓度小于T1时,则T1>T2。
②T2温度下,
Fe(s)+5CO![]() Fe(CO)5(g)
Fe(CO)5(g)
起始(mol/L) 0.5 0
转化(mol/L) 0.4 0.08
平衡(mol/L) 0.1 0.08
平衡常数K=![]() =
=![]() =8×103,
=8×103,
故答案为:> ;8×103;
(3)①ClO-与Fe3+反应生成FeO42-,ClO-被还原为Cl-,根据得失电子守恒和电荷守恒及原子守恒可得反应的离子方程式为3ClO-+2Fe3++10OH-===2FeO42-+3Cl-+5H2O;
制备K2FeO4时,K2FeO4在Fe3+和Fe(OH)3催化作用下发生分解,应把Fe(NO3)3饱和溶液滴加到KClO溶液中,具体操作为:在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中;
故答案为:3ClO-+2Fe3++10OH-===2FeO42-+3Cl-+5H2O;在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中;
②由图可知,pH=6时溶液主要存在HFeO4-,加入KOH溶液发生中和,反应的离子方程式为HFeO4-+OH-===FeO42-+H2O,
故答案为:HFeO4-+OH-===FeO42-+H2O;
(4)铁是阳极失去6个电子,因此阳极电极反应式为Fe-6e-+8OH-=FeO42-+4H2O,
故答案为:Fe-6e-+8OH-===FeO42-+4H2O。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列是典型晶体的结构示意图,从①到⑥对应正确的是:
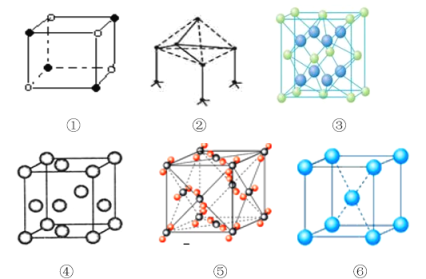
选项 | ① | ② | ③ | ④ | ⑤ | ⑥ |
A | NaCl | 单质硅 | CaF2 | Au | CO2 | K |
B | CaF2 | SiC | 金刚石 | Cu | CO2 | CsCl |
C | CsCl | 金刚石 | CaF2 | Cu | CO2 | Mg |
D | NaCl | BN | Au | CaF2 | CO2 | Na |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1).对于下列反应:2SO2 + O2 ![]() 2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为__________,用O2浓度变化来表示的反应速率为__________。
2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为__________,用O2浓度变化来表示的反应速率为__________。
(2)反应N2+3H2![]() 2NH3 ΔH<0 ,达平衡后,不同时刻改变外界条件时正逆反应速率变化如图,请判断某时刻所改变的条件。
2NH3 ΔH<0 ,达平衡后,不同时刻改变外界条件时正逆反应速率变化如图,请判断某时刻所改变的条件。

可能改变的外界条件:t1__________,t2__________ ,t3__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在酸性条件下反应得到:

下列说法正确的是( )
A. X分子中所有碳原子可能共平面
B. X、Y分别与足量H2加成后的分子中均含有手性碳原子
C. Y可以发生显色、氧化和还原反应,还可以与甲醛发生缩聚反应
D. 等物质的量的X、Y分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸和一水合氨是中学化学中常见的弱电解质。
(1)常温下,某研究性学习小组设计了如下方案证明醋酸为弱电解质,你认为方案可行的是_______(填序号)
①配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则证明醋酸为弱电解质。
②用醋酸溶液和盐酸做导电性实验,若醋酸溶液导电性弱,则证明醋酸为弱电解质。
③将pH=2的CH3COOH溶液加水稀释100倍后,若pH>4,则证明醋酸为弱电解质。
④配制一定量的CH3COONa溶液,测其pH,若pH大于7,则证明醋酸为弱电解质。
(2)若25℃时,0.10 mol/L的CH3COOH的电离度为1%,则该溶液的pH=________,由醋酸电离出的c(H+)约为水电离出的c(H+)的_________倍。
(3)已知在25℃时,醋酸的电离平衡常数为Ka=1.8×10-5。常温下,0.1mol/LNaOH溶液V1 mL和0.2mol/LCH3COOH溶液V2 mL混合后(忽略混合前后溶液体积的变化)溶液的pH=7。
①反应后溶液中离子浓度的大小关系为_________________________________________________。
②V1:V2 __________(填“>”、“<”或“=”)2:1
③c(CH3COO-):c(CH3COOH)=__________________。
(4)常温下,可用氨水吸收废气中的CO2得到NH4HCO3溶液,在该溶液中,c(NH4+)_______(填“>”、“<”或“=”)c(HCO3-);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
NH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过如下流程制备氧化亚铜:

已知CuCl难溶于水和稀硫酸:Cu2O+2H+==Cu2++Cu+H2O
下列说法不正确的是
A. 步骤②SO2可用Na2SO3替换
B. 步骤③中为防止CuCl被氧化,可用SO2水溶液洗涤
C. 步骤④发生反应的离子方程式为2CuCl+2OH-=Cu2O+2Cl-+H2O
D. 如果Cu2O试样中混有CuCl和CuO杂质,用足量稀硫酸与Cu2O试样充分反应,根据反应前、后固体质量可计算试样纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于氧化还原反应的是
A.CuSO4+H2S=CuS↓+H2SO4B.2FeCl3+Cu=2FeCl2+CuCl2
C.Cu2(OH)2CO3![]() 2CuO+CO2↑+H2OD.FeCl3+3NaOH=Fe(OH)3↓+3NaCl
2CuO+CO2↑+H2OD.FeCl3+3NaOH=Fe(OH)3↓+3NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷和镍均为重要的无机材料,在化工领域具有广泛的应用。
(1)基态As原子的价层电子的电子云轮廓图形状为_____________。与砷同周期的主族元素的基态原子中,第一电离能最大的为_____________(填元素符号。)
(2)Na3AsO3可用于碘的微量分析。
①Na+的焰色反应呈黄色,金属元素能产生焰色反应的微观原因为__________________________。
②Na3AsO3中所含阴离子的立体构型为_____________,写出一种与其互为等电子体的分子:_____________(填化学式)。
(3) 可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含
可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含![]() 键和π键的数目之比为___________。
键和π键的数目之比为___________。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。区分晶体Ni和非晶体Ni的最可靠的科学方法为___________。
(5)某砷镍合金的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,则该晶体的密度ρ=___________g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+ 5O2(g)![]() 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
A. 达到化学平衡时,4υ正(O2)= 5υ逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D. 化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com