
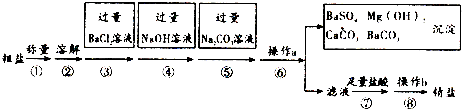
分析 (1)实现固体和液体的分离的步骤a是过滤,氯化钠溶液蒸发结晶获得氯化钠晶体的过程要用到玻璃棒,作用是:使滤液受热均匀,防止液体飞溅;
(2)过量的氯化钡会将全部的硫酸根离子沉淀完毕,只要是氯化钡剩余,则氯化钡会与硫酸钠反应出现白色沉淀;
(3)除杂的原则:加入试剂除去杂质离子,但是不能引进新杂质,碳酸钠既能除去杂质离子还能除去新引入的杂质离子,据此回答.
解答 解:实验流程为:粗盐样品含有Na2SO4、MgCl2、CaCl2等杂质,加入过量的氯化钡,可以将硫酸根离子除去,但是会引入钡离子杂质离子,加入过量氢氧化钠溶液的目的是除去氯化镁,加入过量的碳酸钠溶液的目的除去杂质CaCl2和加入的过量试剂BaCl2,过滤,将得到的沉淀全部滤出,得到的滤液是含有氯化钠、碳酸钠、氢氧化钠等的混合物,加入足量的盐酸,可以出去碳酸根离子、氢氧根离子等杂质离子,最后即可获得较为纯净的氯化钠.
(1)实现固体和液体的分离的步骤a是过滤,操作b是对氯化钠溶液蒸发结晶获得氯化钠晶体的过程,此时玻璃棒的作用是:使滤液受热均匀,防止液体飞溅,故答案为:过滤;使滤液受热均匀,防止液体飞溅;
(2)过量的氯化钡会将全部的硫酸根离子沉淀完毕,只要是氯化钡剩余,则氯化钡会与硫酸钠反应出现白色沉淀,所以判断BaCl2已过量的方法是:取少量样品于试管中,滴入Na2SO4溶液,若有白色沉淀产生,则Bacl2过量,
故答案为:取少量样品于试管中,滴入Na2SO4溶液,若有白色沉淀产生,则Bacl2过量;
(3)加入过量的碳酸钠溶液的目的除去杂质CaCl2和加入的过量试剂BaCl2,加入足量的盐酸,可以出去碳酸根离子、氢氧根离子等杂质离子,最后即可获得较为纯净的氯化钠,若加入足量的硫酸,则会在氯化钠中引入硫酸根杂质离子,故答案为:除CaCl2和过量的BaCl2;不能.
点评 本题主要考查了盐的性质、除杂的方法和原则,题目难度不大,除去多种杂质时,要考虑加入试剂的顺序,为了保证将杂质除尽,所加试剂必须过量,因此为了不引进新的杂质,后面加入的试剂要能够除去前面所进入的过量试剂.


科目:高中化学 来源: 题型:选择题
| A. | 20g NaOH溶于1L水中 | |
| B. | 58.5g NaCl溶于水配成1L溶液 | |
| C. | 28g KOH溶于水配成1L溶液 | |
| D. | 通常状况下,11.2L HCl气体溶于水配成1L溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖、果糖和蔗糖都能发生水解反应 | |
| B. | 糖类都可以与新制氢氧化铜悬浊液和银氨溶液反应 | |
| C. | 淀粉、油脂和蛋白质都属于天然高分子化合物 | |
| D. | 可用灼烧的方法鉴别蚕丝和人造丝(纤维素) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸中滴加氨水:H++OH-═H2O | |
| B. | 用FeCl3溶液腐蚀铜线路板:Cu+Fe3+═Cu2++Fe2+ | |
| C. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 物理性质 | 化学性质 |
| 草酸(H2C2O4) | ①易溶于水 ②熔点189.5℃、100℃开始升华 ③草酸钙和草酸氢钙均是白色不溶物 | ①二元弱酸、酸性比碳酸强 ②有毒、具有腐蚀性 ③157℃左右分解、与浓硫酸混合会产生H2O、CO和CO2 |
| 草酸亚铁晶体(FeC2O4•2H2O) | ①浅黄色粉末状晶体 ②微溶于水,难溶于丙酮 | 受热易分解为氧化亚铁或铁单质 |
| 丙酮 | 与水互溶、易挥发 | ---- |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:H2SiO3<H3PO4<H2SO4<HClO4 | |
| B. | 碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3 | |
| C. | 熔点:Li<Na<K | |
| D. | 热稳定性:HF>HCl>H2S>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④ | B. | ②>③>④>① | C. | ①>③>②>④ | D. | ③>①>②>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1知,浓硫酸与氢氧化钠反应生成l mol H2O放出57.3KJ的热量 | |
| B. | 氯气和氨气的水溶液都能导电,所以它们是电解质 | |
| C. | 将纯水的温度由25℃升高至100℃,水的离子积将变大,pH也升高,此时呈现中性 | |
| D. | 除去MgCl2溶液中少量的FeCl3,可以加入MgO,然后过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com