
1mol CH4与Cl2发生取代反应,待反应完成后测得4种取代物的物质的量相等,则消耗的Cl2为
A.0.5molB.2molC.2.5molD.4mol
科目:高中化学 来源:2013-2014山西大学附中高三第二学期5月理科综合化学试卷(解析版) 题型:填空题
[化学――选修5:有机化学基础](15分)
添加塑化剂可改善白酒等饮料的口感,但不应超过规定的限量。DBP是一种酯类塑化剂,可由下列路线合成:
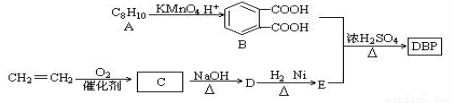
已知以下信息:
①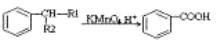
②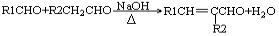 (-R1、-R2表示氢原子或烃基)
(-R1、-R2表示氢原子或烃基)
(1)A的结构简式 ,D的结构简式是 ,D→E的反应类型 ;
(2)D和H2 1︰1反应生成E,则E官能团名称为_________,DBP的分子式为
(3)由B和E以物质的量比1︰2合成DBP的化学方程式: ;
(4)写出2种同时符合下列条件的B的同分异构体结构简式 ;
①能和NaHCO3溶液反应生成CO2 ③能使FeC13溶液发生显色反应
②能发生银镜反应 ④苯环上含碳基团处于对位
(5)写出B与碳酸氢钠溶液反应的方程式 ,
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市高三4月模拟考试理综化学试卷(解析版) 题型:简答题
(18分)某化学研究小组探究溴化亚铁水溶液与氯气反应。
(1)该小组同学用下图所示装置制取干燥纯净的氯气。
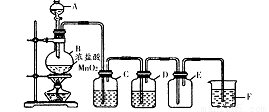
仪器A的名称是________,装置C中的试剂是________,装置F的作用是________;写出制备氯气的离子方程式________。
(2)该小组同学对Cl2与FeBr2溶液的反应进行实验探究。
【实验过程】
向l00mL0. 1mol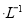 的溶液缓缓通入100 mLCl2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl2,溶液黄色加深,变为棕黄色。
的溶液缓缓通入100 mLCl2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl2,溶液黄色加深,变为棕黄色。
【提出假设】上述现象发生的原因可能是:
假设1:Cl2先将Fe2+氧化生成Fe3+,溶液逐渐变黄色,Cl2再把Br-氧化成Br2,溶液变为棕黄色。
假设2:Cl2先将Br-氧化生成Br2,溶液逐渐变黄色,Cl2再把Fe2+氧化成Fe3+,溶液变为棕黄色。
【实验方案】
方案甲:设计实验验证由浅绿色逐渐变黄色的原因________(说明实验操作、现象和结论)。
方案乙:设计对比实验验证氧化性顺序

根据实验得出Cl2、Fe3+、Br2氧化性由强到弱的顺序为________,上述假设合理的是________。
(3)若向含有0.1 molFeBr2的溶液中通人0.1molCl2充分反应,写出反应的离子方程式:________ 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高二化学试卷(解析版) 题型:选择题
在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下:
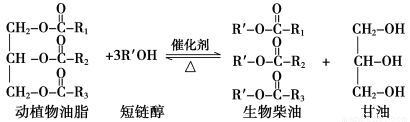
下列叙述错误的是
A.生物柴油由可再生资源制得
B.生物柴油是不同酯组成的混合物
C.动植物油脂是高分子化合物
D.“地沟油”可用于制备生物柴油
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高二化学试卷(解析版) 题型:选择题
向有机物X中加入合适的试剂(可以加热),检验其官能团。下列有关结论错误的是
选项 | 试剂 | 现象 | 结论 |
A | 金属钠 | 有气体产生 | 含羟基或羧基或羟基、羧基 |
B | 银氨溶液 | 产生银镜 | 含有醛基 |
C | 碳酸氢钠溶液 | 产生气泡 | 含有羧基 |
D | 溴水 | 溶液褪色 | 含有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高一化学试卷(解析版) 题型:简答题
(14分)铁、铝、铜、硅及其合金材料在生产生活中有着广泛的应用。请回答下列有关问题。
(1)目前已冶炼出纯度达99.9999%的铁。下列关于纯铁的叙述错误的是
(填字母)。
A.硬度比钢小,熔点比钢高 B.不能与盐酸反应
C.与不锈钢成分相同 D.在冷的浓硫酸中钝化
E.在潮湿的空气中放置不易生锈
(2)铝热反应可用于焊接钢轨、冶炼熔点较高的金属。请写出用V2O5冶炼钒的化学方程式:
(3)①铜在干燥的空气中性质稳定,在潮湿的空气里会被锈蚀形成一层绿色的铜锈,反应的化学方程式是
②工业上常以黄铜矿为原料,采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,该反应的氧化剂是
6Cu+SO2↑,该反应的氧化剂是
③将铜粉放入稀硫酸中加热并不断鼓入空气,铜溶解,产物只有硫酸铜与水 。
该反应的化学方程式: ,
此法比直接用浓硫酸与铜反应有两个明显的优点:
。
(4)制备高纯硅的流程如下图:

写出石英砂制备粗硅的化学方程式:
。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高一化学试卷(解析版) 题型:选择题
已知短周期元素的离子aA2+、bB+ 、 cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A.原子序数:d>c>b>a
B.原子半径:r (A)>r (B) >r (D)> r (C)
C.单质的还原性:A>B >D>C
D.离子半径:r (C3-)>r (D-)>r (B+)>r (A2+)
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省淄博市高三第三次模拟考试理综化学试卷(解析版) 题型:填空题
(18分)运用化学反应原理研究氮、氯等单质及其化合物的反应有重要意义。
(1)科学家研究在一定条件下通过下列反应制备NH3:
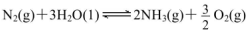
①在其他条件相同时,反应中NH3的体积分数(a)在不同温度下随反应时间(t)的变化如图。该反应的平衡常数表达式K=______,该反应中的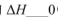 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
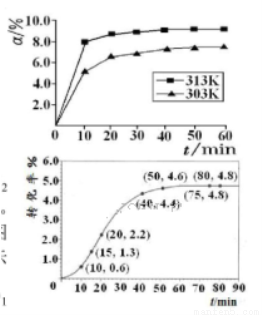
②某温度下,在2L容积不变的密闭容器中加入1molN2和6molH2O(1)发生反应,N2转化率随时间(t)变化如图。15-20min内,v(NH3)=____。若其他条件不变,在图中画出使用催化剂后N2的转化率随反应时间变化的曲线示意图。
(2) 25℃时,某同学将0.lmol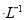 盐酸与0.2 mol
盐酸与0.2 mol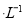 氨水等体积混合,所得混合溶液pH______7(填“>”“<”或“=”,下同),混合溶液中
氨水等体积混合,所得混合溶液pH______7(填“>”“<”或“=”,下同),混合溶液中 (25℃时,NH3.H2O的电离常数
(25℃时,NH3.H2O的电离常数 )
)
(3) 25℃时,向O.lmol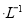 的MgCl2溶液中逐滴加入适量0.lmol
的MgCl2溶液中逐滴加入适量0.lmol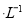 氨水,有白色沉淀生成,向反应后的浊液中,继续加入O.lmol
氨水,有白色沉淀生成,向反应后的浊液中,继续加入O.lmol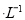 的FeCl3溶液,观察到的现象是______ ;上述过程中发生的所有反应的离子方程式为______。(25℃时,
的FeCl3溶液,观察到的现象是______ ;上述过程中发生的所有反应的离子方程式为______。(25℃时,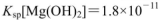 ,
,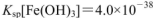 )
)
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市高一5月质量检测化学试卷(解析版) 题型:填空题
(9分)(1)写出下列反应的化学方程式,并注明反应条件和反应类型。
①乙烯和氯化氢反应的化学方程式:_______________________________________,
反应类型:_____________________________________________________________;
②苯和浓硝酸反应的化学方程式:__________________________________________,
反应类型:______________________________________________________________;
③苯和溴反应的化学方程式:_______________________________,
反应类型:______________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com