
����Ŀ����һ���¶��£������������ǿ��淴ӦA(g)+2B(g)![]() 2C(g)�ﵽƽ��״̬��־����
2C(g)�ﵽƽ��״̬��־����
��C������������C�ķֽ�������ȣ�
����λʱ������amol A��ͬʱ����3amolB��
��A��B��C��Ũ�Ȳ��ٱ仯��
���������ƽ��Ħ���������ٱ仯
������������ѹǿ���ٱ仯��
�������������ʵ������ٱ仯��
����λʱ��������amol A��ͬʱ����3amol B ��A��B��C�ķ�������Ϊ1��3��2
A. �ڢ� B. �٢� C. �ڢ� D. �ۢ�
���𰸡�A
�����������������������C��������C�ֽ��������ȣ����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬������ѡ�������۷�Ӧ�Ƿ�ﵽƽ��״̬�����ڵ�λʱ��������a mol Aͬʱ����3a mol B�����Բ��ܾݴ��ж�ƽ��״̬����ѡ����A��B��C��Ũ�Ȳ��ٱ仯ʱ�����淴Ӧ������ȣ��÷�Ӧ�ﵽƽ��״̬������ѡ�����������ƽ����Է��������ǻ�����������ͻ�������ܵ����ʵ����ı�ֵ���������䣬�����ʵ����DZ仯�ģ���˻������ƽ��Ħ���������ٱ仯˵����Ӧ�ﵽƽ��״̬������ѡ�����÷�Ӧǰ�����������֮�ͼ�С��ѹǿ��С��������������ѹǿ���ٱ仯ʱ�������ʵ����ʵ������䣬��Ӧ�ﵽƽ��״̬������ѡ������Ӧǰ�����������ʵ�����С���������������ʵ������ٱ仯ʱ���淴Ӧ������ȣ��÷�Ӧ�ﵽƽ��״̬������ѡ������λʱ��������a mol A��ͬʱ����3a mol B������amolA�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬������ѡ����A��B��C�ķ�����֮��Ϊ1��3��2���÷�Ӧ��һ���ﵽƽ��״̬���뷴Ӧ��ʼŨ�ȼ�ת�����йأ����Բ��ܾݴ��ж�ƽ��״̬����ѡ����ѡA��


 ������ϵ�д�
������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����30 mL 0.5mol/L��NaOH��Һ��ˮϡ�͵�500 mL��ϡ�ͺ�NaOH�����ʵ���Ũ��Ϊ ( )
A. 0.3 mol/L B. 0.03 mol/L C. 0.05 mol/L D. 0.04 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���ʽ��ʾ�����ʣ�����ͬ���칹����ǣ�������
A. C2H5Cl B. C3H8 C. CH2Cl2 D. C2H6O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ����������������ԭ�����͵���
A������ˮ�м���AgNO3��Һ����Һ��ɫ��dz
B����2HI(g) ![]() H2(g)+I2(g)ƽ����ϵ�������С��ѹǿ�����ʹ��ɫ����
H2(g)+I2(g)ƽ����ϵ�������С��ѹǿ�����ʹ��ɫ����
C���ϳɰ���Ӧ���ù���������������Ӧ�������������ת����
D����������еİ���Һ����ͣ�ķ�������������ںϳɰ��ķ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�ͬ���칹���˵����ȷ���ǣ�������
A. ͬ���칹���̼ԭ����һ����ͬ
B. ͬ���칹��ķ���ʽ��һ����ͬ
C. ͬ���칹��֮�����������
D. ͬ���칹������һ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij����ZARn+ �� ��Ԫ��R��ԭ�������ǣ� ��
A.Z
B.A��Z
C.Z��n
D.Z+n
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⻯����ʵ�����г��õķ����Լ�����ҵ������м��ԭ���Ʊ�NaI��������ͼ��ʾ��

��ش��������⣺
��1���жϷ�Ӧ���е��Ƿ�Ӧ��ȫ�ķ����� ��
��2���������������� ��
��3����Ӧ���Ļ�ѧ����ʽΪ ��
��4����Ӧ����NaIO3��Fe���ʻ�ԭΪNaI��ͬʱ����Fe��OH��3��д���÷�Ӧ�Ļ�ѧ����ʽ����˫���ŷ���ʾ�˷�Ӧ�ĵ���ת�Ƶķ�����Ŀ
��5���ڷ�Ӧ��������99 g NaIO3����ԭ����ת�Ƶ��ӵ����ʵ���Ϊ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ������ˮ�Ĵ���ԭ���ǽ�Cr2O72��ת��ΪCr3+���ٽ�Cr3+ת��ΪCr��OH��3�������������Ṥҵ�����е�SO2����������ˮ���ȳ��������Դ���Է��ηϣ����ܽ�Լ�����ɱ���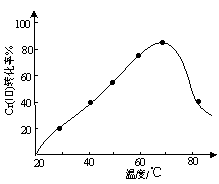
��1����ҵ�ϴ���100 L Cr2O72������Ϊ108 mg��L��1�ĺ�����ˮ��������Ҫ L����״����SO2��
��2����֪��Ksp[Cr��OH��3]��1��10��30�������£���ȥ��SO2��ԭ������Һ�е�Cr3����ʹ��Ũ��С��1��10��6 mol��L��1�����������ҺpH ��
��3�����۸�Cr������˫��ˮ��Ӧ�����ںϳɸ�����PbCrO4�������������������䣬���ڷ�Ӧ�¶ȣ����췴Ӧ�¶ȶ�Cr����ת���ʵ�Ӱ������ͼ��ʾ�����¶ȳ���70��ʱ��Cr����ת�����½���ԭ���� ��
��4�������£����ᣨH2C2O4��Ҳ�ܽ�Cr2O72��ת��ΪCr3+����ѧʽΪAl2Fe��SO4��4��ij������ë��״���ڿ������ܱ��������Ը÷�Ӧ���д����á�Ϊȷ��һƿ���÷��εĻ�ѧ�ɷ֣�ѧϰС���������ʵ�飺
ȡһ�������ķ�����Ʒ����������ϡ�����У�����Һ��Ϊ���ȷݡ�����һ��������KMnO4��Һ��ַ�Ӧ����Ӧ��MnO4������ԭ��Mn2+��������Ũ��Ϊ0��4000mol��L��1��KMnO4��Һ20��00mL������һ����Һ�м�������ϡ��ˮ���ڿ������Ȳ�����ʹ֮��ַ�Ӧ�����������ٱ仯����ˣ�������ϴ�Ӳ�������պ��������9��100g��������ĩ��
ͨ��������������룬�Ʋ�þ��÷��εĿ��ܻ�ѧ��������������������Ʋ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ѧ��ӦN2��3H2��2NH3�������仯��ͼ��ʾ���÷�Ӧ���Ȼ�ѧ����ʽ�ǣ�N2(g)��3H2(g)��2NH3(l)���SH�� ��

��2����298Kʱ��1mol C2H6 ����������ȫȼ������CO2��Һ̬ˮ���ų�����1558.3kJ��д���÷�Ӧ���Ȼ�ѧ����ʽ ��
��3��SiH4��һ����ɫ���壬���������ܷ�����ը����ȼ������SiO2������H2O(l)����֪������2 g SiH4��ȼ�ų�����89.2 kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ ��
��4����֪��Ӧ��N2(g)��O2(g)��2NO(g) ��H1
2H2(g)��O2(g)��2H2O(g) ��H2
N2(g)��3H2(g)��2NH3(g) ��H3
��������������Ӧ������4NH3(g)+5O2(g)��4NO(g)+6H2O(g)��H4�ķ�Ӧ�ʱ�Ϊ (�ú���H1����H2����H3��ʽ�ӱ�ʾ)��
��5����H2O2��H2SO4�Ļ����Һ���ܳ�ӡˢ��·�������ĩ�е�ͭ����֪��
��Cu��s����2H����aq��=Cu2����aq����H2��g�� ��H1����64.39 kJ��mol��1
��2H2O2��l��=2H2O��l����O2��g�� ��H2����196.46 kJ��mol��1
��H2��g����![]() O2��g��=H2O��l�� ��H3����285.84 kJ��mol��1
O2��g��=H2O��l�� ��H3����285.84 kJ��mol��1
��H2SO4��Һ�У�Cu��H2O2��Ӧ����Cu2����H2O���Ȼ�ѧ����ʽΪ_________________��
��6������֪����ӦH2(g)+Cl2(g)=2HCl(g) ��H=��184kJ/mol
4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ��H=��115.6kJ/mol
2Cl2(g)+2H2O(g) ��H=��115.6kJ/mol
![]()
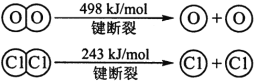
��ش�
H2��O2��Ӧ������̬ˮ���Ȼ�ѧ����ʽ
�Ͽ�1 mol H��O ����������ԼΪ kJ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com