
有机物F是一种新型涂料固化剂,可由下列路线合成(部分反应条件略去):
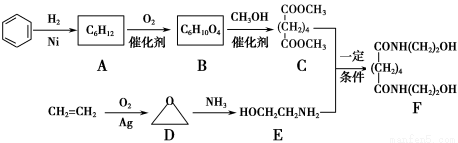
(1)B的结构简式是____________;E中含有的官能团名称是________。
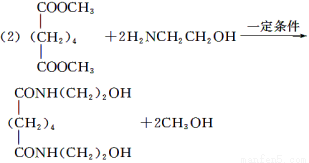
(2)由C和E合成F的化学方程式是___________________________________________
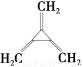
(3)同时满足下列条件的苯的同分异构体的结构简式是________________。
①含有3个双键 ②核磁共振氢谱只显示1个吸收峰 ③不存在甲基
(4)乙烯在实验室可由______(填有机物名称)通过________(填反应类型)制备。
(5)下列说法正确的是________(填字母序号)。
a.A属于饱和烃 b.D与乙醛的分子式相同 c.E不能与盐酸反应 d.F可以发生酯化反应
(1)HOOC(CH2)4COOH 羟基、氨基
(3)
(4)乙醇 消去反应(其他合理答案均可)
(5)abd
【解析】根据合成路线图中已知物质的结构简式,推断出其他物质的结构简式,按照题目要求解答相关问题即可。(1)B和甲醇反应生成C,根据C的结构简式可以判断B为二元羧酸;E分子中有两种官能团:氨基和羟基。(2)观察C、E、F三者的结构简式,可知C和E反应即为E中的HOCH2CH2NH—取代了C中的—OCH3,同时生成两分子的甲醇。(3)苯的分子式为C6H6,离饱和烃还差8个氢原子,条件①该分子中存在3个双键,要满足碳、氢比,分子中还应存在一个环状结构;条件②说明该分子呈对称结构,分子中氢的位置是相同的;再结合条件③即可写出该物质的结构简式。(4)实验室中是利用浓硫酸和乙醇反应制取乙烯的,该反应类型为消去反应。(5)A是环己烷,属于饱和烃,所以a项正确;D的分子式为C2H4O,其分子式和乙醛的相同,所以b项正确;E分子中含有氨基,可以和盐酸反应,所以c项错误;F分子中含有羟基,可以和羧酸发生酯化反应,所以d项正确。


 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源:2014高考化学二轮专题突破 专题四氧化还原反应练习卷(解析版) 题型:选择题
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
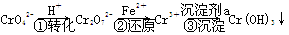
其中第①步中存在平衡:2CrO42- (黄色)+2H+??Cr2O72- (橙色)+H2O。下列有关说法正确的是( )
A.第①步当2v(Cr2O72-)=v(CrO42-)时,达到了平衡状态
B.对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成
C.第②步中,还原0.1 mol Cr2O72-需要45.6 g FeSO4
D.第③步沉淀剂a可以使用NaOH等碱性物质
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十五综合实验探究练习卷(解析版) 题型:实验题
3,5?二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5?二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20 ℃) /g·cm-3 | 溶解性 |
甲醇 | 64.7 | — | 0.791 5 | 易溶于水 |
乙醚 | 34.5 | — | 0.713 8 | 微溶于水 |
3,5?二甲氧基苯酚 | — | 33~36 | — | 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是________________。②萃取用到的分液漏斗使用前需________并洗净,分液时有机层在分液漏斗的________(填“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是________;用饱和食盐水洗涤的目的是________________________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是________(填字母)。
a.蒸馏除去乙醚 b.重结晶
c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先________,再________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十三无机化学综合应用练习卷(解析版) 题型:填空题
工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下:
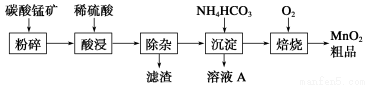
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Pb(OH)2 | Mn(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 8.0 | 8.3 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.8 | 9.8 |
请回答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是__________________。
(2)酸浸后的溶液中含有Mn2+、SO42—,另含有少量Fe2+、Fe3+、Al3+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其离子反应方程式为__________________________。
②加入CaO将溶液的pH调到5.2~6.0,其主要目的是
_____________________________________________________________。
③加入BaS,除去Cu2+、Pb2+后,再加入NaF溶液,除去______________________。
(3)从溶液A中回收的主要物质是________________,该物质常用作化肥。
(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2。写出Mn3O4与稀硫酸反应的化学方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十七有机化学基础练习卷(解析版) 题型:推断题
二甲氧苄胺嘧啶是一种用于家禽细菌感染防治药。其合成路线如下:
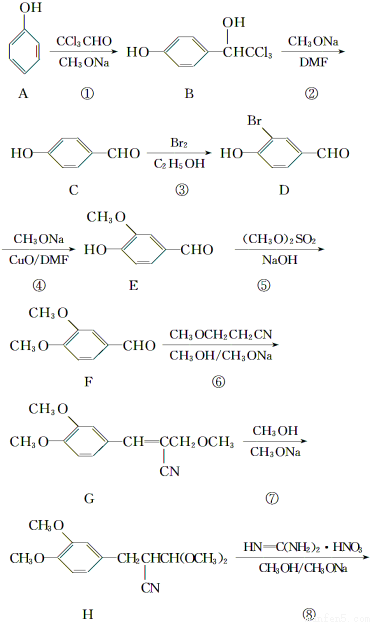
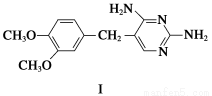
(1)化合物F的含氧官能团名称为________、__________;合成路线中,步骤①、④的反应类型分别为______________、____________。
(2)化合物B的核磁共振氢谱中有________个峰。
(3)写出F与新制氢氧化铜反应的化学方程式_______________________________。
(4)写出同时满足下列条件的E的同分异构体的结构简式:__________________________。
Ⅰ.分子中苯环上有两个取代基;
Ⅱ.能发生银镜反应;
Ⅲ.不能与FeCl3溶液发生显色反应,但水解产物之一能发生此反应;
Ⅳ.核磁共振氢谱显示有4个峰。
(5)实验生产的产品中存在一种结构为 的副产物,为了使该产物的含量降到最低,需要合成路线中第________步反应的工艺最优化。
的副产物,为了使该产物的含量降到最低,需要合成路线中第________步反应的工艺最优化。
(6)已知 。化合物
。化合物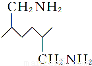 是合成染料的中间体,请写出以氯乙烷为原料制备该化合物的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
是合成染料的中间体,请写出以氯乙烷为原料制备该化合物的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2OH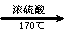 CH2=CH2
CH2=CH2 ?CH2—CH2?
?CH2—CH2?
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十一常见金属元素练习卷(解析版) 题型:选择题
常温常压下过氧化钠可与CO2反应,与CO不反应。现将CO2、CO的混合气体在一定条件下和足量过氧化钠充分反应后,若固体质量增加了28 g,下列说法正确的是( )
A.反应过程中,电子转移数为2NA
B.固体生成物的质量为106 g
C.CO可能有剩余
D.反应后一定生成11.2 L氧气
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十一常见金属元素练习卷(解析版) 题型:选择题
实验室中使用铝盐制备氢氧化铝,为了使其中的铝元素完全转化为目标产物,应该选用的试剂是( )
A.碳酸 B.稀硫酸 C.氢氧化钠溶液 D.氨水
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题八电化学练习卷(解析版) 题型:填空题
以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎。
Ⅱ.采用如下装置进行电化学浸出实验
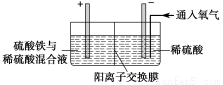
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相)  R2Cu(有机相)+2H+(水相)
R2Cu(有机相)+2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
①阳极区硫酸铁的主要作用是____________。
②电解过程中,阳极区Fe3+的浓度基本保持不变,原因是______________________。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式____________________。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是__________;加入有机萃取剂的目的是__________。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是____________。
(5)步骤Ⅳ,若电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是__________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题九化学反应速率化学平衡练习卷(解析版) 题型:填空题
工业上合成氨的反应:N2(g)+3H2(g)  2NH3(g)ΔH=-92.60 kJ·mol-1。
2NH3(g)ΔH=-92.60 kJ·mol-1。
(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)  2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成2n mol H—H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
NH3 | 0 | 0.20 |
| 1.00 | 1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com