
| A. | 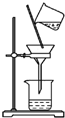 除去粗盐溶液中的不溶物(滤纸未画出) | |
| B. | 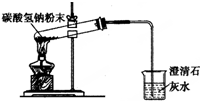 碳酸氢钠受热分解 | |
| C. | 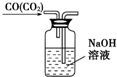 除去CO中的CO2 | |
| D. | 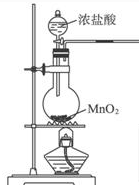 制取氯气 |
分析 A.过滤时漏斗下端应紧靠烧杯内壁;
B.碳酸氢钠受热分解有水生成;
C.除杂时导管应长进短出;
D.浓盐酸与二氧化锰加热反应生成氯气.
解答 解:A.过滤时遵循一贴、二低、三靠,漏斗下端应紧靠烧杯内壁,操作不合理,故A错误;
B.碳酸氢钠受热分解有水生成,则试管口应略向下倾斜,故B错误;
C.除杂时导管应长进短出,图中导管的进气方向不合理,故C错误;
D.浓盐酸与二氧化锰加热反应生成氯气,制备原理及装置合理,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、实验装置的作用、实验技能等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
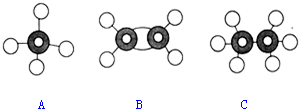
| A. | 原子核内有10个中子的氧原子818O | B. | 乙烯的结构简式为:C2H4 | ||
| C. | CH4分子的比例模型: | D. | -CH3(甲基)的电子式为: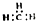 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇中的水(生石灰,蒸馏) | B. | 乙烷中的乙烯(酸性KMnO4溶液,洗气) | ||
| C. | 溴苯中的溴(KI溶液,分液) | D. | 乙酸乙酯中的乙酸(NaOH溶液,蒸馏) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热前消耗的多 | |
| B. | 加热后消耗的多 | |
| C. | 加热前后均消耗0.02amolHCl | |
| D. | 当n(NaOH)>n(NaHCO3)时消耗的才会一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 (10-10m) | 0.73 | 1.02 | 1.34 | 1.06 | 0.99 | .5 4 | 0.75 | 1.18 |
| 最高或最 低化合价 | +6 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 哈伯法合成氨是吸热反应,新法合成氨是放热反应 | |
| B. | 新法合成和哈伯法相比不需要在高温条件下,可节约大量能源,具有发展前景 | |
| C. | 新法合成能在常温下进行是因为不需要断裂化学键 | |
| D. | 新的催化剂升高了反应所需要的能量,提高了活化分子百分数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com