
【题目】合成氨技术的创立开辟了人工固氮的重要途径。回答下列问题:
(1)德国化学家F.Haber从1902年开始研究N2和H2直接合成NH3。在1.01×105Pa、250℃时,将1 molN2和1 molH2加入aL刚性容器中充分反应,测得NH3体积分数为0.04;其他条件不变,温度升高至450℃,测得NH3体积分数为0.025,则可判断合成氨反应为 ____填“吸热”或“放热”)反应。
(2)在1.01×105Pa、250℃时,将2 moIN2和2 molH2加入aL密闭容器中充分反应,H2平衡转化率可能为 ___(填标号)。
A =4% B <4% C 4%~7% D >11.5%
(3)我国科学家结合实验与计算机模拟结果,研究了在铁掺杂W18049纳米反应器催化剂表面上实现常温低电位合成氨,获得较高的氨产量和法拉第效率。反应历程如图所示,其中吸附在催化剂表面的物种用*标注。

需要吸收能量最大的能垒(活化能)E=____ev,该步骤的化学方程式为____,若通入H2体积分数过大,可能造成 ___。
(4)T℃时,在恒温恒容的密闭条件下发生反应:![]() 反应过程中各物质浓度的变化曲线如图所示:
反应过程中各物质浓度的变化曲线如图所示:

①表示N2浓度变化的曲线是 ____(填“A”、“B”或“C’,)。与(1)中的实验条件(1.01×105Pa、450℃)相比,改变的条件可能是_____。
②在0~25min内H2的平均反应速率为____。在该条件下反应的平衡常数为 ___mol-2.L2(保留两位有效数字)。
【答案】放热 D 1.54 NH3*+NH3=2NH3 占据催化剂活性位点过多 B 加压强或降温 0.006mol·L-1·min-1 0.73
【解析】
(1)升高温度,NH3体积分数降低;
(2)在1.01×105Pa、250℃时,将2 moIN2和2 molH2加入aL密闭容器中充分反应,与在1.01×105Pa、250℃时,将1 moIN2和1 molH2加入aL密闭容器中充分反应比,相当于加压;
(3)吸收能量最大的能垒,即相对能量的差最大;根据图示写方程式;
(4)根据反应方程式,N2、H2、NH3的变化量比为1:3:2;图氢气的转化率为25%,(1)中氢气的转化率是11.5%,根据转化率的变化分析;
②A表示氢气的浓度变化,根据![]() 计算H2的平均反应速率;根据
计算H2的平均反应速率;根据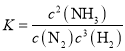 计算平衡常数;
计算平衡常数;
(1)升高温度,NH3体积分数降低,说明升高温度平衡逆向移动,正反应放热;
(2)在1.01×105Pa、250℃时,将1 molN2和1 molH2加入aL刚性容器中充分反应,测得NH3体积分数为0.04;
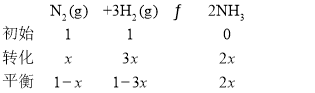
![]()
![]() ,x=0.0384,H2平衡转化率
,x=0.0384,H2平衡转化率![]() ,在1.01×105Pa、250℃时,将2 moIN2和2 molH2,相当于加压,平衡正向移动,氢气转化率增大,H2平衡转化率>11.5%,故选D;
,在1.01×105Pa、250℃时,将2 moIN2和2 molH2,相当于加压,平衡正向移动,氢气转化率增大,H2平衡转化率>11.5%,故选D;
(3)根据图示,吸收能量最大的能垒,即相对能量的差最大是-1.02-(-2.56)=1.54;根据图示,该步的方程式是NH3*+NH3=2NH3;若通入H2体积分数过大,氢分子占据催化剂活性位点过多;
(4)①根据反应方程式,N2、H2、NH3的变化量比为1:3:2,所以表示N2浓度变化的曲线是B;(1)中氢气转化率11.5%,1:3时氢气转化率更低,图中氢气转化率25%,故只能考虑压强、温度的影响,可以采用加压或降温的方法;
②A表示氢气的浓度变化, ![]() 0.006mol·L-1·min-1;
0.006mol·L-1·min-1;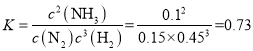 mol-2.L2。
mol-2.L2。


科目:高中化学 来源: 题型:
【题目】Fe2+、Fe3+与O22-、CN-、F-有机分子等形成的化合物具有广泛的应用。
(1)C、N、O原子的第一电离能由大到小的顺序是___________________________。
(2)Fe2+基态核外电子排布式为_____________________________。
(3)乙酰基二茂铁是常用汽油抗震剂,其结构如图1所示。
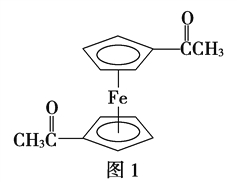
此物质中碳原子的杂化方式是______________________。
(4)配合物K3Fe(CN)6可用于电子传感器的制作。与配体互为等电子体的一种分子的化学式为________。已知(CN)2是直线型分子,并具有对称性,则(CN)2中π键和σ键的个数比为_____________。
(5)F-不仅可与Fe3+形成[FeF6]3-,还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,结构如图2所示。

该晶体的化学式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:a.C2H2(g)+ H2(g)= C2H4(g)ΔH<0
b. 2CH4(g)= C2H4(g)+ 2H2(g)ΔH>0
判断以下3个热化学方程式:
①C(s)+ 2H2(g)= CH4(g)ΔH1
②C(s)+ ![]() H2(g)=
H2(g)= ![]() C2H2(g)ΔH2
C2H2(g)ΔH2
③C(s)+ H2(g)= ![]() C2H4(g)ΔH3
C2H4(g)ΔH3
ΔH1、ΔH2、ΔH3由大到小的顺序是( )
A. ΔH2 >ΔH3 >ΔH1 B. ΔH3 >ΔH2 >ΔH1
C. ΔH3 >ΔH1 >ΔH2 D. ΔH1 >ΔH2 >ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:

(1)电解质由强至弱顺序为___(用化学式表示,下同)。
(2)常温下,0.02mol·L-1的CH3COOH溶液的电离度约为___,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者___后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____。
(4)NaHSO3溶液显酸性的原因_____(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,关于1L pH=3的H2SO4溶液说法正确的是
A.与等体积pH=11氨水混合后所得溶液pH小于7
B.与等浓度的CH3COONa溶液混合后所得溶液pH一定小于7
C.与pH=3的CH3COOH溶液混合后所得溶液pH小于3
D.与10L Ba(OH)2溶液恰好完全反应,则Ba(OH)2溶液的pH一定等于10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铝(AlPO4)是一种用途广泛的材料,可在玻璃生产过程中充当助熔剂,作陶瓷或牙齿的黏合剂等。以磷硅渣[主要成分为Ca3(PO4)2、Al2O3、SiO2和V2O5等]为原料制备磷酸铝的工艺流程如图所示:
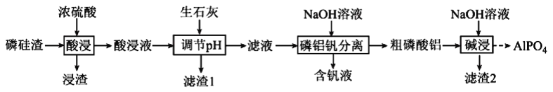
请回答下列问题:
(1)浸渣中含有SiO2,试写出SiO2的一种重要用途__;酸浸中磷元素主要转化为H3PO4,该反应的化学方程式为__。
(2)生石灰除了调节pH外,另一作用是__。
(3)滤液中钒元素以V3O93-形式存在,V3O93-易水解为[VO3(OH)]2-,该水解反应的离子方程式为__。
(4)碱浸时,粗磷酸铝转化为可溶性溶质,则可溶性溶质分别是__(填化学式)。
(5)实验测得pH、反应温度与时间对碱浸时固相中P、Al含量w%的影响如图所示:
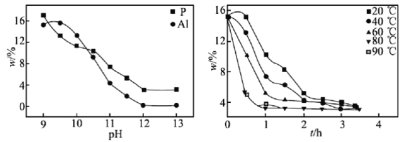
则最优反应条件是__。
(6)在物质的量浓度分别为0.01mol·L-1的CaCl2和AlCl3的混合溶液中加入等体积的Na3PO4溶液,若A13+恰好沉淀完全,即溶液中c(A13+)=1.0×10-5mol·L-1,此时AlPO4沉淀中__(填“是”或“否”)混有Ca3(PO4)2。[已知AlPO4、Ca3(PO4)2的Ksp分别为6.3×10-19、2.0×10-29]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,30g乙烷气体中所含有的共价键数目为7NA
B.1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去2NA个电子
C.0.5mol雄黄(As4S4,结构为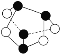 )中含有NA个S—S键
)中含有NA个S—S键
D.6.0gSiO2晶体中含有的分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表中的五种元素A、B、D、E、F,原子序数依次增大,A的基态原子价层电子排布为nsnnpn;B的基态原子2p能级有3个单电子;D是一种富集在海水中的元素,含量位于海水中各元素的第三位;E2+的3d轨道中有10个电子;F位于第六周期,与Cu同族,其单质在金属活动性顺序表中排在末位。
(1)写出E的基态原子的价层电子排布式___________。
(2)A、B形成的AB﹣常作为配位化合物中的配体,其A原子的杂化方式为________,AB﹣中含有的σ键与π键的数目之比为________。
(3)FD3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态、还是气态,它都是以二聚体F2D6的形式存在,依据以上信息判断FD3,晶体的结构属于____晶体,写出F2D6的结构式________。
(4)E、F均能与AB﹣形成配离子,已知E与AB﹣形成的配离子为正四面体形。F(+1价)与AB形成的配离子为直线形,工业上常用F和AB﹣形成的配离子与E反应来提取F单质,写出E置换F的离子方程式_________________。
(5)F单质的晶体为面心立方最密堆积,若F的原子半径为a nm,F单质的摩尔的的质量为Mg/mol,阿伏加德罗常数为NA,求F单质的密度为______g/cm3。(用a、NA、M的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于盐类水解的说法错误的是( )
A.pH相等的①NaHCO3、②Na2CO3、③NaOH溶液的物质的量浓度大小:①>②>③
B.浓度均为0.1 mol·L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为①>②>③
C.在NH4Cl溶液中加入稀HNO3,能抑制NH4+水解
D.在CH3COONa溶液中加入冰醋酸,能抑制CH3COO-水解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com