
| A. | 结构示意图为 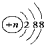 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| B. | 球棍模型为  的分子可发生加成反应 的分子可发生加成反应 | |
| C. | 邻硝基甲苯的结构简式为 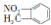 ,能发生取代反应 ,能发生取代反应 | |
| D. | 电子式分别为 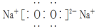 和 和 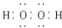 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |
分析 A.如果n=16,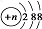 为硫离子,硫离子能够破坏水的电离平衡;
为硫离子,硫离子能够破坏水的电离平衡;
B. 为比例模型;
为比例模型;
C.C与N成键;
D.过氧化钠和过氧化氢中O元素都为-1价,可以得电子,故都可作为氧化剂.
解答 解:A.结构示意图为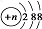 的阴离子中,当n=16时,表示的为S2-,硫离子能够结合水电离的氢离子,促进水的电离,故A错误;
的阴离子中,当n=16时,表示的为S2-,硫离子能够结合水电离的氢离子,促进水的电离,故A错误;
B. 为比例模型,不是球棍模型,含碳碳双键,可发生加成反应,故B错误;
为比例模型,不是球棍模型,含碳碳双键,可发生加成反应,故B错误;
C.硝基的N原子与苯环相连,邻硝基甲苯正确的结构简式为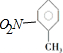 ,甲基及苯环上H可发生取代反应,故C错误;
,甲基及苯环上H可发生取代反应,故C错误;
D.电子式分别为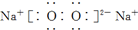 和
和 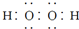 的两种化合物中O元素都为-1价,可以得电子,故都可作为氧化剂,故D正确;
的两种化合物中O元素都为-1价,可以得电子,故都可作为氧化剂,故D正确;
故选D.
点评 本题考查化学用语,为高频考点,把握结构示意图、电子式、结构简式为解答的关键,侧重分析与应用能力的考查,注意化学用语的区别及规范使用,题目难度不大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
| 4 | ⑩ |
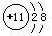 .元素⑩名称为溴.
.元素⑩名称为溴.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol.L-1硫酸钠溶液中含有溶质离子总数为1.5NA | |
| B. | 标准状况下,22.4L甲醇完全燃烧产生NA个CO2分子 | |
| C. | 常温常压下,46g NO2、N2O4混合物中,分子数为NA | |
| D. | 常温常压下,N2和O2混合气体22.4L所含的分子数少于6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗盐提纯蒸发时,待水分完全蒸干后停止加热 | |
| B. | 过滤时,漏斗下口尖端紧贴烧杯内壁 | |
| C. | 蒸馏时,冷却水应从冷凝管上口进下口出 | |
| D. | 分液操作时,上层液体应从分液漏斗下口放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.
中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com