
| 滴定次数 | 待测液体积/ml | 标准盐酸体积/ml | |
| 滴定前读数/ml | 滴定后读数/ml | ||
| 第一次 | 10.00 | 0.20 | 22.90 |
| 第二次 | 10.00 | 0.50 | 20.40 |
| 第三次 | 10.00 | 4.00 | 24.10 |
| 第四次 | 10.00 | 0.00 | 20.00 |
分析 根据C(待测)=$\frac{C(标准)×V(标准)}{V(待测)}$计算,V(标准)用几次的平均值;根据m=cVM计算250mL烧碱样品中氢氧化钠的质量,再根据质量分数公式计算氢氧化钠的质量分数.
解答 解:第一次实验消耗的盐酸的体积偏大,舍去,则V(标准)=$\frac{19.90+20.10+20.00}{3}$=20.00mL,
c(待测)=$\frac{0.2010mol/L×0.0200L}{0.0100L}$=0.4020mol•L-1,
m=cVM=0.4020mol•L-1×0.25L×40g/mol=4.020g
ω(NaOH)=$\frac{4.020g}{4.10g}$×100%=98%,
故答案为:98%.
点评 本题考查了物质含量的测定,主要考查了溶液的配制、酸碱中和滴定的操作、数据处理和物质含量的计算等,题目难度不大,掌握中和滴定的原理是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=6的溶液一定呈酸性 | |
| B. | c(H+)水电离产生=c(OH-)水电离产生的溶液一定呈中性 | |
| C. | 使石蕊试液显红色的溶液一定呈酸性 | |
| D. | 强酸和强碱等物质的量混合后溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| D. | 古剑“湛泸”“以剂钢为刃,剂钢指的是铁的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
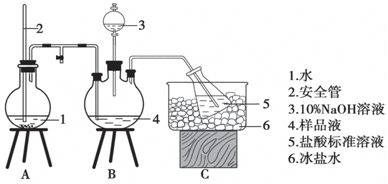 某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.
某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| 溶解度(mol•L-1) | 1.3410-6 | 7.110-7 | 1.110-8 | 6.510-5 | 1.010-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 | 标准溶液的体积/mL | 待测盐酸溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 1.05 | 21.10 | 15.00 |
| 2 | 2.00 | 21.95 | 15.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com